YY 0321.3-2009
基本信息
标准号: YY 0321.3-2009
中文名称:一次性使用麻醉用过滤器
标准类别:医药行业标准(YY)
英文名称:Single-use filter for anaesthesia
标准状态:已作废
发布日期:2009-06-16
实施日期:2010-12-01
作废日期:2023-09-01
下载格式:pdf zip

标准分类号
标准ICS号: 医药卫生技术>>医疗设备>>11.040.20输血、输液和注射设备
中标分类号:医药、卫生、劳动保护>>医疗器械>>C31一般与显微外科器械
关联标准
出版信息
出版社:中国标准出版社
页数:12页
标准价格:16.0
出版日期:2010-12-01
相关单位信息
起草人:罗勇、吴其玉
起草单位:武汉智迅创源科技发展有限公司
归口单位:全国医用注射器(针)标准化技术委员会
提出单位:国家食品药品监督管理局
发布部门:国家食品药品监督管理局
主管部门:国家食品药品监督管理局
标准简介
YY0321的本部分规定了一次性使用麻醉用过滤器的要求。
本部分适用于一次性使用麻醉用过滤器,与一次性使用麻醉穿刺针配套使用。
标准图片预览




标准内容
ICS 11. 040.20
中华人民共和国医药行业标准
YY0321.3—2009
代替YY0321.3—2000
一次性使用麻醉用过滤器
Single-use filter for anaesthesia2009-06-16 发布
国家食品药品监督管理局
2010~12-01实施
YY0321分为以下几个郝分:
次性使用麻醉穿刺包;
次性使用麻酵针;
-次性使用麻醉用过滤器。
本部分为YY0321的第3部分。
本部分代誉YY0321.3—2000一次性使用麻醉用过滤器》本部分与YY0321.3-2000相比主要技术改是:二.增加了药液过滤器过滤介质的孔径要求(本部分5.3.1);YY 0321.3—2009
修改了药液过滤器过滤效率的试验方法(YY0321—2000 4.2.2.1及附录 A;本部分 5.3.1及第A.1章)
修改了药液过滤器液体流量指标及试验方法(YY0321一20004.2.4及附录C;本部分5.6);改了药液过滤器微粒污染试验方法(YY0321—2000附录B;本部分第A.1章)-取消了空气过滤器的生物学评价要求(本部分第7章)修改了检验规则(YY0321—2000第6章,本部分附录B)。本部分附录 A、附录 B为规范性附录。本部分由国家食品药品监督管理局提出。本部分由全国医用注射器(针)标推化技术委员会归门。本部分负资起草单位:武汉智迅创源科技发展有限公司。本部分参与起草单位:北京伏尔特技术有限公司、浙江伏尔特医疗器裁有限公司。本部分主娶起草人:罗勇、吴其玉。本部分参与起草人:婴绍军、马建强、沈钰琴。本部分于2000年9月首次发布,2009年第一次警订。T
1范围
一次性使用麻醉用过滤器
YY0321的本部分规定了一次性使用麻醉用过滤器的要求。YY 0321.3—2009
本部分适用于一次性使用麻醉用过滤器(以下简称过滤器),与一次性使用麻醇穿刺针配套使用。2规范性引用文件
下列文件中的条款通过YY0321的本部分的引用而成为本部分的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本部分,然而,鼓励根据本部分达成协议的各方研究是否可使用这些标准的最新版本,凡是不注日期的引用文件,其最新版本适用于本部分。GB/T1962.1注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分:通用要求GB/T1962.2注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头GB8368一次性使用输液器重力输液式GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB15810一次性使用无菌注射器
GB/T16886.1医疗器械生物学评价:第1部分:评价与试验YY0466医疗器械用于医疗器械标签、标记和提供信息的符号3分类与标记
3.1分类
过滤器分为空气过滤器和药液过滤器。3. 2结构型式
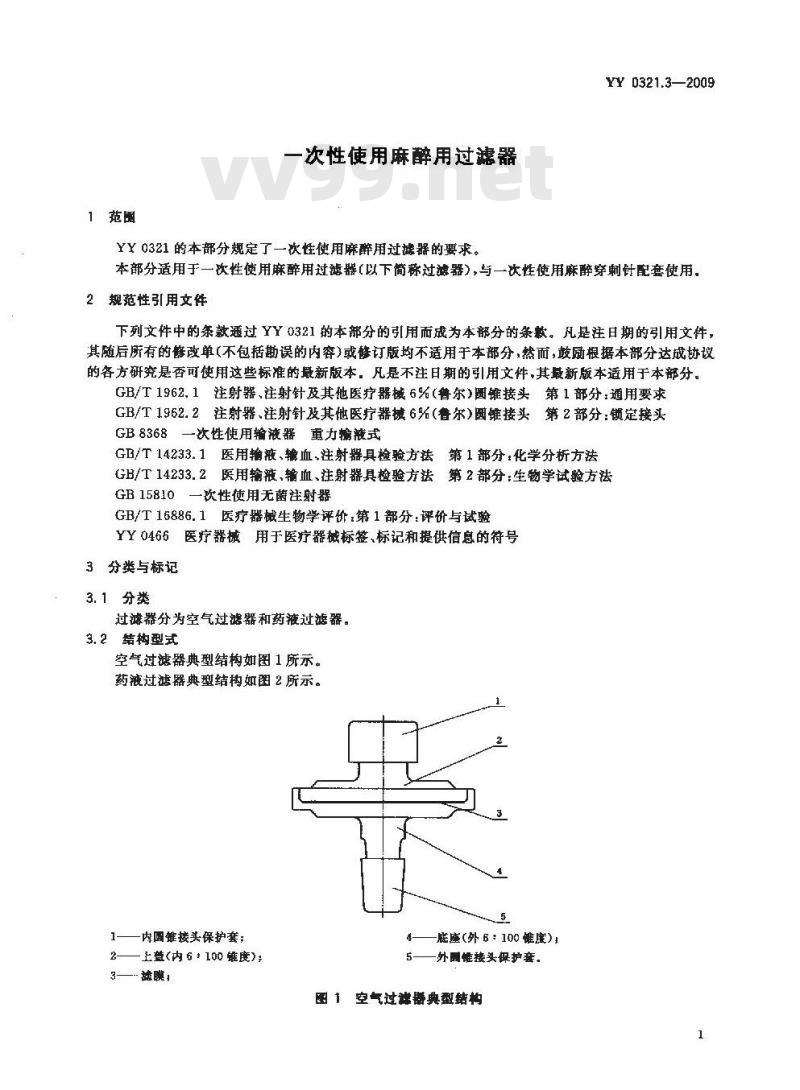
空气过滤器典型结构如图1所示。药液过滤器典型结构如函2所示。5
一内国锥接头保护套;
—上益(内6*100维度):
3——- 糖膜,
4——脏座(外 6 : 100 维度);
5——外围惟接头保护套。
图 1 空气过弹器典型结构
YY0321.3—2009
内圆接头保护套
上盖(内6·100锥
滤膜;
底座(外6:10
外园链接头保护餐
图2药液过滤器典型结构
注1:本示意图仅说明过滤器的结构,并非为本标准规定的唯一型式注2:配置在麻降包的药液过这器可不加链接头保护套S
3.3标记
产品型号标记由品名称代号·分类代号及标称孔径组成产品店称代号:过滤器以AF表示。分类代空气过滤器以A表示,药液过滤器以L表示标记示例1:过游介质标称孔径为0.5#m的空气过滤器S
标记示例2:过减介质标称孔径为2.。um的药液过滤器AFL2.0
4材料
生产过滤器及其部件用材料应符合第5章的要求。与药液接触的部件,其材料还应符合第6章和第7章的要求。
物理要求
5.1外观
以正常视力或矫正视力观察,过滤器外表面应光洁,无毛刺、杂质,裂痕等缺陷。5.2接头
过滤器接头应符合GB/T1962.1和/或GB/T1962.2的规定。5.3滤除率
5.3.1药液过滤器过滤介质标称孔径应不大于2.0μm,按第A.1章试验时,药液过滤器滤除率应不小于90%。
5.3.2空气过滤器按第A.2章试验时,滤除空气中≥0.5μm的微粒的滤除率应不小于90%。5.4密合性
5.4.1药液过滤器按A.3.1试验时,应无液体泄漏现象。5.4.2空气过滤器按A.3.2试验时,应无气体泄漏现象。2
5.5微粒污染
YY0321.3-—2009
药液过滤器按第A.4章试验或其他等效方法测定微粒污染时,60mL洗脱液中,≥5.0pm的微粒不得超过100个/mL。
5.6液体流量
药液过滤器在300kPa压力下,1min内通过药液过滤器流出的0.9%氯化钠注射液应不小于200mL。
6化学要求
在同一批产品中随机抽取过滤器若干,按材料表面积(cm2)与蒸馏水(mL)为2:1的比例加人符合《中华人民共和国药典》的蒸留水,使其内外表面完全浸湿,加盖,置于3?℃士1℃下浸泡1h。收集全部浸提液并冷却。同时制备空白对照液。6.1还原物质(易氧化物)
按GB/T14233.1回接简定法试验时,检验液和空白液消耗高锰酸钾溶液[c(KMnO)=0.002mol/L的体积之差应不超过2.0mL
6.2金属离子
按GB/T14233比色法试验时,检验液皇现的颜色应不超过质量浓度p(Pb>+)=1ug/mL的标准对照液。
按GB/T14233.1原子吸收分光光度法试验时,镉的含量应不超过0.114g/mL6.3酸碱度
按GB/T
43.1酸度计法进行试验,检验液与空白液pHI值之差应不超过1.0。6.4环氧乙烷残留量
过滤器经环氧乙烧灭菌后,按照GB/T14233.1进行试验,其残留量应不大于0.1mg。7生物要求
药液过滤器在新产品投产时材料发生重大改变时,应按GB/T16886.1的规定对细胞毒性、皮内刺激反应、退发性超敏反应、急性全身毒性和血液相容性进行生物学评价。7.1无菌
过滤器应通过一灭菌确认的过程和常规控制使产品无菌。注1:适宜的灭菌确认和常规控制见GB18278.GB18279和GB18280。注2:GB/T14233.2中规定了无菌试验方法,该方法可用于型式试验而不适宜于出厂检验,7.2细菌内毒素
过滤器按GB/T14233.2凝胶法试验时,其含量应不超过20FU/套。8标志
8.1初包装
初包装上至少应有下列信息:
a)产品名称、产品型号;
b)制造商名称和地址;
c)产品注册证号、执行标准号;d)使用YY0466给出的图形符号,标明过滤器无菌;e)
过滤器无热原:
过滤器仅供一次性使用,或同等说明,或使用符合YY0466给出的图形符号;D
使用说明,包括检查包装密封完整性和有关保护套脱落情况的警示;g)
YY 0321.3--2009
生产批号,或以\批”字或LOT\头,或使用符合YY0466给出的图形符号;h)
失效年月,附以适当文字,或使用符合YY0466给出的图形符号,i)
药液过滤器药液残留盘,www.vv99.net
)过滤介质孔径。
8.2外包装
外包装上至少应有下列信息:
产品名称、产品型号;
制造商名称和地址;
使用YY0466给出的图形符号,标明过滤器无菌:c)
生产批号,或以\批”字或“LOT”打头+或使用符合YY0466给出的图形符号;失效年月,附以适当文字,或使用符合YY0466给出的图形符号;推荐的贮存条件(如果有)。
附录A
(规范性附录)
物理试验
A,1药液过滤器滤除率试验(粒子计数器法)A,1. 1 试验仪器
粒子计数器:包括电阻法或光阻法,有搅拌系统,一次取样量不小于1mL。A, 1.2 试验液
按表A.1的要求选择胶乳粒子悬浮液作为试验液。表 A.1试验悬浮液中胶乳粒手的技术要求过滤介质标称孔径
A 1. 3步骤
。粒子蜂值粒径
1. 9~-2. 3
粒径的变异系数
粒径计数范围
YY 0321.3—2009
粒径计数范围内的粒子数量(N.)个/mL
1 500~3 000
A.1.3.1取100mL试验液(A.1.2),注入洁净的计数器的样品池中,按表A.1中粒径计数范围对样品池内试验液中的胶乳粒子计数(N),总取样量不少于15mL。注:测得的N。值须满足表A.1规定.A.1.3.2取100mL试验液(A1.2),采用注射器将其注人药液过滤器,泄过液流人洁净的计数器的样品池中,按表A,1中粒径计数范围对样品池内滤过液中的胶乳粒子计数(N),总取样量不少于15 mL.
A1.4结果囊示
式(A 1)给出药液过滤器的滤除率,以百分数表示:药液过滤器滤除率=【1
式中:
N…-试验获中得的粒子数,单位为个每毫升(个/mI.);N,“:滤过液中测得的粒子数,单位为个每毫升(个/mL)。A.2空气过滤器滤除率试验
A2.1试验弱
×100%
尘埃粒子计数器:采样管长度为 1 m。采样次数为 1 次/min。转子流量计。
A,2. 2试验步骤
在静态环境条件下,将尘埃粒子计数器与流量计相连在空气流量为50mL/min下,测定1min内采集的空气中≥0.5严m的徽粒数,连续读取五个数据。另取空气过滤器按使用方向使其与流量计进气口相连,在相同空气流量下,测定1min内流经空气过滤器后的空气中≥0.5μm的微粒数,连续读取五个数据。将连续读取的五个数据中的最大值和最小值去掉,取其余三个数据的平均值。A,2. 3结果表示
式(A.2)给出空气过滤器的滤除率,以百分数表示:5
YY 0321.3-2009
式中:
空气过滤器滤除率=(
N.空气中20.5um的微粒平均数;N
×100%
Ni——流经空气过滤器后的空气中≥0.5μm的微粒平均数。A, 3密合性试验
A,3. 1药液过蹭器密合性试验
将蒸馏水从药液过滤器进液增注人,另一端封闭,施加300kPa压力观察15s,不得有液体渗漏现象。
空气过津器密合性试验
以80kPa压力将气体从空气过滤器进气端注人,另一端封闭,将空气过滤器漫入20℃~30C水中,观察15s,不得有气体泄漏现象。A, 4微粒污染试验
A. 4. 1 原理
这一方法是通过冲洗药液过滤器内腔,收集药液过滤器洗脱液中的粒子,并对其计数来评价污染。A,4.2试验仪器
粒子计数器:包括电阻法或光阻法,有搅拌系统,一次取样量不小于1mL。A, 4. 3种洗液
水或0.9%氯化钠注射被,经孔径为0.2μm的微孔滤膜过滤。A.4.4预处理
将供试药液过滤器充满符合A,4.3的液体,常温下浸泡1h。A,4.5步
取 60 mL冲洗液,采用注射器将其注人预处理后的药液过滤器,流人道净的计数器的样品池中,即得洗脱液。对样品池内洗脱液中≥5.0μm的粒子计数,总取样量不少于15mL。A.4.6结果表示
以洗脱液中微粒含量(个/mL)报告结果。B. 1检验项目
附录B
(规范性附录)
型式检验规购
检验项目为本标准第5章至第7章的各项要求。B. 2抽样数量
若光特殊规定,每项性能各随机抽检5只。B,3判定规则
YY 0321.32009
所有检验项目均合格,则通过型式检验。检验中若第6章、第7章中的要求全部合格,第5章中的要求出现不合格项时,允许再次加倍抽样,对不合格项进行复验,复验仍不合格,则型式检验不通过。YY0321.3-2009
中华人民共和国医药
行业标准
一次性使用麻醇用过选摄
YY 0321,3—2009
中国标准出版杜出版发行
北京复兴门外三里河北街16 号
邮政编码:100045
网址 spc. net. cn
电话:6852394668517548
中国标推出版社泰皇部印刷厂印刷各地新华书店经销
并本880×1230
2009年12月第·-版
印张0.75
字数 14 千宇
2009年12月第一次印剧
书号:155066·2-20056
定价16.00元
由本社发行中心调换
如有印装差错
版权专有
慢权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY0321.3—2009
代替YY0321.3—2000
一次性使用麻醉用过滤器
Single-use filter for anaesthesia2009-06-16 发布
国家食品药品监督管理局
2010~12-01实施
YY0321分为以下几个郝分:
次性使用麻醉穿刺包;
次性使用麻酵针;
-次性使用麻醉用过滤器。
本部分为YY0321的第3部分。
本部分代誉YY0321.3—2000一次性使用麻醉用过滤器》本部分与YY0321.3-2000相比主要技术改是:二.增加了药液过滤器过滤介质的孔径要求(本部分5.3.1);YY 0321.3—2009
修改了药液过滤器过滤效率的试验方法(YY0321—2000 4.2.2.1及附录 A;本部分 5.3.1及第A.1章)
修改了药液过滤器液体流量指标及试验方法(YY0321一20004.2.4及附录C;本部分5.6);改了药液过滤器微粒污染试验方法(YY0321—2000附录B;本部分第A.1章)-取消了空气过滤器的生物学评价要求(本部分第7章)修改了检验规则(YY0321—2000第6章,本部分附录B)。本部分附录 A、附录 B为规范性附录。本部分由国家食品药品监督管理局提出。本部分由全国医用注射器(针)标推化技术委员会归门。本部分负资起草单位:武汉智迅创源科技发展有限公司。本部分参与起草单位:北京伏尔特技术有限公司、浙江伏尔特医疗器裁有限公司。本部分主娶起草人:罗勇、吴其玉。本部分参与起草人:婴绍军、马建强、沈钰琴。本部分于2000年9月首次发布,2009年第一次警订。T
1范围
一次性使用麻醉用过滤器
YY0321的本部分规定了一次性使用麻醉用过滤器的要求。YY 0321.3—2009
本部分适用于一次性使用麻醉用过滤器(以下简称过滤器),与一次性使用麻醇穿刺针配套使用。2规范性引用文件
下列文件中的条款通过YY0321的本部分的引用而成为本部分的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本部分,然而,鼓励根据本部分达成协议的各方研究是否可使用这些标准的最新版本,凡是不注日期的引用文件,其最新版本适用于本部分。GB/T1962.1注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分:通用要求GB/T1962.2注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头GB8368一次性使用输液器重力输液式GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB15810一次性使用无菌注射器
GB/T16886.1医疗器械生物学评价:第1部分:评价与试验YY0466医疗器械用于医疗器械标签、标记和提供信息的符号3分类与标记
3.1分类
过滤器分为空气过滤器和药液过滤器。3. 2结构型式
空气过滤器典型结构如图1所示。药液过滤器典型结构如函2所示。5
一内国锥接头保护套;
—上益(内6*100维度):
3——- 糖膜,
4——脏座(外 6 : 100 维度);
5——外围惟接头保护套。
图 1 空气过弹器典型结构
YY0321.3—2009
内圆接头保护套
上盖(内6·100锥
滤膜;
底座(外6:10
外园链接头保护餐
图2药液过滤器典型结构
注1:本示意图仅说明过滤器的结构,并非为本标准规定的唯一型式注2:配置在麻降包的药液过这器可不加链接头保护套S
3.3标记
产品型号标记由品名称代号·分类代号及标称孔径组成产品店称代号:过滤器以AF表示。分类代空气过滤器以A表示,药液过滤器以L表示标记示例1:过游介质标称孔径为0.5#m的空气过滤器S
标记示例2:过减介质标称孔径为2.。um的药液过滤器AFL2.0
4材料
生产过滤器及其部件用材料应符合第5章的要求。与药液接触的部件,其材料还应符合第6章和第7章的要求。
物理要求
5.1外观
以正常视力或矫正视力观察,过滤器外表面应光洁,无毛刺、杂质,裂痕等缺陷。5.2接头
过滤器接头应符合GB/T1962.1和/或GB/T1962.2的规定。5.3滤除率
5.3.1药液过滤器过滤介质标称孔径应不大于2.0μm,按第A.1章试验时,药液过滤器滤除率应不小于90%。
5.3.2空气过滤器按第A.2章试验时,滤除空气中≥0.5μm的微粒的滤除率应不小于90%。5.4密合性
5.4.1药液过滤器按A.3.1试验时,应无液体泄漏现象。5.4.2空气过滤器按A.3.2试验时,应无气体泄漏现象。2
5.5微粒污染
YY0321.3-—2009
药液过滤器按第A.4章试验或其他等效方法测定微粒污染时,60mL洗脱液中,≥5.0pm的微粒不得超过100个/mL。
5.6液体流量
药液过滤器在300kPa压力下,1min内通过药液过滤器流出的0.9%氯化钠注射液应不小于200mL。
6化学要求
在同一批产品中随机抽取过滤器若干,按材料表面积(cm2)与蒸馏水(mL)为2:1的比例加人符合《中华人民共和国药典》的蒸留水,使其内外表面完全浸湿,加盖,置于3?℃士1℃下浸泡1h。收集全部浸提液并冷却。同时制备空白对照液。6.1还原物质(易氧化物)
按GB/T14233.1回接简定法试验时,检验液和空白液消耗高锰酸钾溶液[c(KMnO)=0.002mol/L的体积之差应不超过2.0mL
6.2金属离子
按GB/T14233比色法试验时,检验液皇现的颜色应不超过质量浓度p(Pb>+)=1ug/mL的标准对照液。
按GB/T14233.1原子吸收分光光度法试验时,镉的含量应不超过0.114g/mL6.3酸碱度
按GB/T
43.1酸度计法进行试验,检验液与空白液pHI值之差应不超过1.0。6.4环氧乙烷残留量
过滤器经环氧乙烧灭菌后,按照GB/T14233.1进行试验,其残留量应不大于0.1mg。7生物要求
药液过滤器在新产品投产时材料发生重大改变时,应按GB/T16886.1的规定对细胞毒性、皮内刺激反应、退发性超敏反应、急性全身毒性和血液相容性进行生物学评价。7.1无菌
过滤器应通过一灭菌确认的过程和常规控制使产品无菌。注1:适宜的灭菌确认和常规控制见GB18278.GB18279和GB18280。注2:GB/T14233.2中规定了无菌试验方法,该方法可用于型式试验而不适宜于出厂检验,7.2细菌内毒素
过滤器按GB/T14233.2凝胶法试验时,其含量应不超过20FU/套。8标志
8.1初包装
初包装上至少应有下列信息:
a)产品名称、产品型号;
b)制造商名称和地址;
c)产品注册证号、执行标准号;d)使用YY0466给出的图形符号,标明过滤器无菌;e)
过滤器无热原:
过滤器仅供一次性使用,或同等说明,或使用符合YY0466给出的图形符号;D
使用说明,包括检查包装密封完整性和有关保护套脱落情况的警示;g)
YY 0321.3--2009
生产批号,或以\批”字或LOT\头,或使用符合YY0466给出的图形符号;h)
失效年月,附以适当文字,或使用符合YY0466给出的图形符号,i)
药液过滤器药液残留盘,www.vv99.net
)过滤介质孔径。
8.2外包装
外包装上至少应有下列信息:
产品名称、产品型号;
制造商名称和地址;
使用YY0466给出的图形符号,标明过滤器无菌:c)
生产批号,或以\批”字或“LOT”打头+或使用符合YY0466给出的图形符号;失效年月,附以适当文字,或使用符合YY0466给出的图形符号;推荐的贮存条件(如果有)。
附录A
(规范性附录)
物理试验
A,1药液过滤器滤除率试验(粒子计数器法)A,1. 1 试验仪器
粒子计数器:包括电阻法或光阻法,有搅拌系统,一次取样量不小于1mL。A, 1.2 试验液
按表A.1的要求选择胶乳粒子悬浮液作为试验液。表 A.1试验悬浮液中胶乳粒手的技术要求过滤介质标称孔径
A 1. 3步骤
。粒子蜂值粒径
1. 9~-2. 3
粒径的变异系数
粒径计数范围
YY 0321.3—2009
粒径计数范围内的粒子数量(N.)个/mL
1 500~3 000
A.1.3.1取100mL试验液(A.1.2),注入洁净的计数器的样品池中,按表A.1中粒径计数范围对样品池内试验液中的胶乳粒子计数(N),总取样量不少于15mL。注:测得的N。值须满足表A.1规定.A.1.3.2取100mL试验液(A1.2),采用注射器将其注人药液过滤器,泄过液流人洁净的计数器的样品池中,按表A,1中粒径计数范围对样品池内滤过液中的胶乳粒子计数(N),总取样量不少于15 mL.
A1.4结果囊示
式(A 1)给出药液过滤器的滤除率,以百分数表示:药液过滤器滤除率=【1
式中:
N…-试验获中得的粒子数,单位为个每毫升(个/mI.);N,“:滤过液中测得的粒子数,单位为个每毫升(个/mL)。A.2空气过滤器滤除率试验
A2.1试验弱
×100%
尘埃粒子计数器:采样管长度为 1 m。采样次数为 1 次/min。转子流量计。
A,2. 2试验步骤
在静态环境条件下,将尘埃粒子计数器与流量计相连在空气流量为50mL/min下,测定1min内采集的空气中≥0.5严m的徽粒数,连续读取五个数据。另取空气过滤器按使用方向使其与流量计进气口相连,在相同空气流量下,测定1min内流经空气过滤器后的空气中≥0.5μm的微粒数,连续读取五个数据。将连续读取的五个数据中的最大值和最小值去掉,取其余三个数据的平均值。A,2. 3结果表示
式(A.2)给出空气过滤器的滤除率,以百分数表示:5
YY 0321.3-2009
式中:
空气过滤器滤除率=(
N.空气中20.5um的微粒平均数;N
×100%
Ni——流经空气过滤器后的空气中≥0.5μm的微粒平均数。A, 3密合性试验
A,3. 1药液过蹭器密合性试验
将蒸馏水从药液过滤器进液增注人,另一端封闭,施加300kPa压力观察15s,不得有液体渗漏现象。
空气过津器密合性试验
以80kPa压力将气体从空气过滤器进气端注人,另一端封闭,将空气过滤器漫入20℃~30C水中,观察15s,不得有气体泄漏现象。A, 4微粒污染试验
A. 4. 1 原理
这一方法是通过冲洗药液过滤器内腔,收集药液过滤器洗脱液中的粒子,并对其计数来评价污染。A,4.2试验仪器
粒子计数器:包括电阻法或光阻法,有搅拌系统,一次取样量不小于1mL。A, 4. 3种洗液
水或0.9%氯化钠注射被,经孔径为0.2μm的微孔滤膜过滤。A.4.4预处理
将供试药液过滤器充满符合A,4.3的液体,常温下浸泡1h。A,4.5步
取 60 mL冲洗液,采用注射器将其注人预处理后的药液过滤器,流人道净的计数器的样品池中,即得洗脱液。对样品池内洗脱液中≥5.0μm的粒子计数,总取样量不少于15mL。A.4.6结果表示
以洗脱液中微粒含量(个/mL)报告结果。B. 1检验项目
附录B
(规范性附录)
型式检验规购
检验项目为本标准第5章至第7章的各项要求。B. 2抽样数量
若光特殊规定,每项性能各随机抽检5只。B,3判定规则
YY 0321.32009
所有检验项目均合格,则通过型式检验。检验中若第6章、第7章中的要求全部合格,第5章中的要求出现不合格项时,允许再次加倍抽样,对不合格项进行复验,复验仍不合格,则型式检验不通过。YY0321.3-2009
中华人民共和国医药
行业标准
一次性使用麻醇用过选摄
YY 0321,3—2009
中国标准出版杜出版发行
北京复兴门外三里河北街16 号
邮政编码:100045
网址 spc. net. cn
电话:6852394668517548
中国标推出版社泰皇部印刷厂印刷各地新华书店经销
并本880×1230
2009年12月第·-版
印张0.75
字数 14 千宇
2009年12月第一次印剧
书号:155066·2-20056
定价16.00元
由本社发行中心调换
如有印装差错
版权专有
慢权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。