GB/T 15805.1-1995
基本信息
标准号: GB/T 15805.1-1995
中文名称:淡水鱼类检疫方法 第1部分
标准类别:国家标准(GB)
英文名称:The quarantine methods of freshwater fish—Part 1
标准状态:已作废
发布日期:1995-01-02
实施日期:1996-07-01
作废日期:2008-11-01
下载格式:pdf zip

标准分类号
标准ICS号: 65.140.30
中标分类号:农业、林业>>水产、渔业>>B50水产、渔业综合
关联标准
出版信息
出版社:中国标准出版社
页数:出版社:
标准价格:13.0
相关单位信息
首发日期:1995-12-08
复审日期:2004-10-14
起草单位:中国水产科学研究院
归口单位:全国水产标准化技术委员会
发布部门:国家技术监督局
主管部门:农业部
标准简介
本标准规定了淡水鱼类传染性胰坏死病(IPN)、传染性造血器官坏死病(IHN)、病毒性出血性败血症(VHS)、斑点叉尾回病毒病(CCVD)、鲤春病毒病(SVC)、疖疮并弧菌病和昏眩病的检疫方法。本标准适用于口岸进口国外淡水鱼类的检疫,也适用于我国国内地区间同种疾病的检疫。
标准图片预览




标准内容
中华人民共和国国家标准
淡水鱼类检疫方法第一部分
The quarantine methods of freshwater fish-Part 11主题内容与适用范围
GB/T 15805.1—1995
本标准规定了淡水鱼类传染性胰坏死病(IPN)、传染性造血器坏死病(IHN)、病毒性出血性败血症(VHS)、斑点叉尾鲫病毒病(CCVD)、鲤春病毒病(SVC)、疗疮病、弧菌病和昏眩病的检疫方法。本标准适用于口岸进口国外淡水鱼类的检疫,也适用于我国国内地区间同种疾病的检疫。2设备和器械
检疫中所用设备和器械除根据各个学科有特殊要求外,均指鱼病实验室常用的设备和器械。3传染性胰坏死病(Infectious Pancreatic Necrosis,简称IPN)该病病原属双链 RNA 病毒。
本病流行于美洲、欧洲和亚洲。主要感染对象是鱼龄6个月以内的虹鳞、美洲红点鲑等鲑鳞鱼类。6个月以上的鱼可以是无症状的带病毒鱼,鱼卵也可携带病毒。3.1临床检查
3.1.1活动情况
病鱼游动失调,常作垂直回转游动,不久便沉入底部死亡。从开始回转游动到死亡的时间为1~2h。在有水流的饲养池中可见失去游泳能力的鱼随水流贴在排水口的拦网上。3.1.2外部检查
病鱼体色暗黑,眼球突出,腹部膨胀。腹壁和鳍基部有出血现象。病鱼多从肛门排出线状粘液样粪便。
3.1.3剖检
除幽门垂出血外,肝脏和脾脏显著褪色,通常消化道内无食物,胃和肠前部积有乳白色粘液而肿胀。3.2实验室检验
3.2.1病毒分离
3.2.1.1细胞准备
a、设备及器械
无菌室、超净工作台、恒温培养箱、低温冰箱(30℃)、液氮罐、赛氏漏斗和0.3,0.45μm混合纤维素酯微孔滤膜、细胞培养瓶、白色橡皮塞等。b.培养基及试剂
细胞生长液、胰酶-EDTA(乙二胺四乙酸)混合消化液、小牛血清、L-谷氨酰胺、碳酸氢钠、酒精。细胞生长液等配制方法见附录A(补充件)。接种前的细胞准备
国家技术监督局1995-12-08批准1996-07-01实施
GB/T15805.1--1995
传染性胰坏死病毒用CHSE-214、RTG-2细胞分离。CHSE-214、RTG-2最适培养温度分别为21℃和20℃。选择生长良好,形成单层的细胞培养物,倒去生长液加入适量胰酶-EDTA混合消化液消化,然后补加生长液,按1:2或1:3的分种率将原瓶消化的细胞分装入2个或3个培养瓶中,置适温中继续培养,当单层致密度达80%左右,即可用于病毒接种。3.2.1.2样品接种
a.设备及器械
同3.2.1.1条a的规定,另增加冷冻离心机和1,2mL规格的移液管。b.常用的溶液
细胞维持液、磷酸缓冲盐水[配制方法见附录A(补充件)]。c.取样
有症状的鱼,取10尾以上样品作病毒分离用。无症状的鱼,取60尾以上样品作病毒分离用。对鱼卵,取60~100粒样品作病毒分离用。对于少量进出口成鱼,从尾动脉抽1~2 mL血液,其血浆作病毒分离用,血清作抗体检测。d.样品处理
较大的鱼取其肾、肝、脾。仔、稚鱼取鱼体全部,若是带卵黄襄的鱼应去掉卵黄囊。鱼卵则取全卵。将上述待检样品称重,加磷酸缓冲盐水(PBS)匀浆,并稀释成10-1,离心30min(4000r/min),弃去沉淀物,将上清液通过0.45μm微孔滤膜除菌,然后再用PBS进行10倍稀释,即成样品。血液样品置于常温下1h后,再放在4℃下12h以上,以析出血清。然后低速离心,其沉淀作待检样品,按上述方法制备样品液,血清作中和试验。e.接种细胞
倒出细胞瓶中的培养液,然后接种样品液,接种量为维持液的10-1,吸附1h后,加细胞维持液培养,同时设对照。
3.2.1.3病毒培养
传染性胰坏死病病(IPNV)培养温度是15~20℃。在培养过程中每日观察细胞变化情况,观察7d结束。
3.2.1.4结果观察
若接种样品含有病毒,培养2~5d后,即出现明显的细胞致病变作用(CPE),主要特征为细胞崩解,细胞单层破坏。收集阳性细胞悬液,冻融一次后,低速离心除去细胞碎片,上清液作病毒鉴定用。若接种后7d仍未见CPE,则判断为阴性结果。若?d内出现可疑CPE现象,则需将该瓶细胞培养液作为接种材料再接种一次,以判断是否有CPE。
3.2.2病毒鉴定
3.2.2.1中和试验【(固定血清用量——稀释病毒法)本试验用于鉴定在细胞培养中出现了CPE的样品是否为IPNV。3.2.2.1.1试验准备
细胞RTG-2细胞培养于 96 孔微量细胞培养板上。a
病毒用标准IPNV毒株,传代后制成病毒悬液。b.
标准抗血清抗IPNV的标准血清,使用前于 56℃灭活60min。c.
d.待检样品(出现了CPE的细胞培养物)冻融一次,除去细胞碎片后使用。3.2.2.1.2操作步骤
3.2.2.1.2.1将待检样品用Hanks液作系列稀释,使其稀释度由10-1到10-3,每管含量为0.5mL。3.2.2.1.2.2取两排试管,分别从上述各稀释度的待检样品中取出0.2mL于两排试管中,然后第一488
GB/T15805.1—1995
排管加入0.2mL抗IPNV标准血清,第二排管加入0.2mL维持液,充分混合均匀。3.2.2.1.2.330℃温育60min。
3.2.2.1.2.4温育后分别将第一排管与第二排管的样品接种于已长满RTG-2细胞单层的96孔微量细胞培养板,每个稀释度4孔,每孔0.1mL。3.2.2.1.2.5将抗IPNV标准血清倍比稀释后(1:8至1:64)接种于上述培养板,每个稀释度4孔,每孔0.05mL,作为标准抗血清对照。将标准IPNV接种8孔,每孔0.05mL,作为病毒对照,其余8孔作为正常细胞对照。
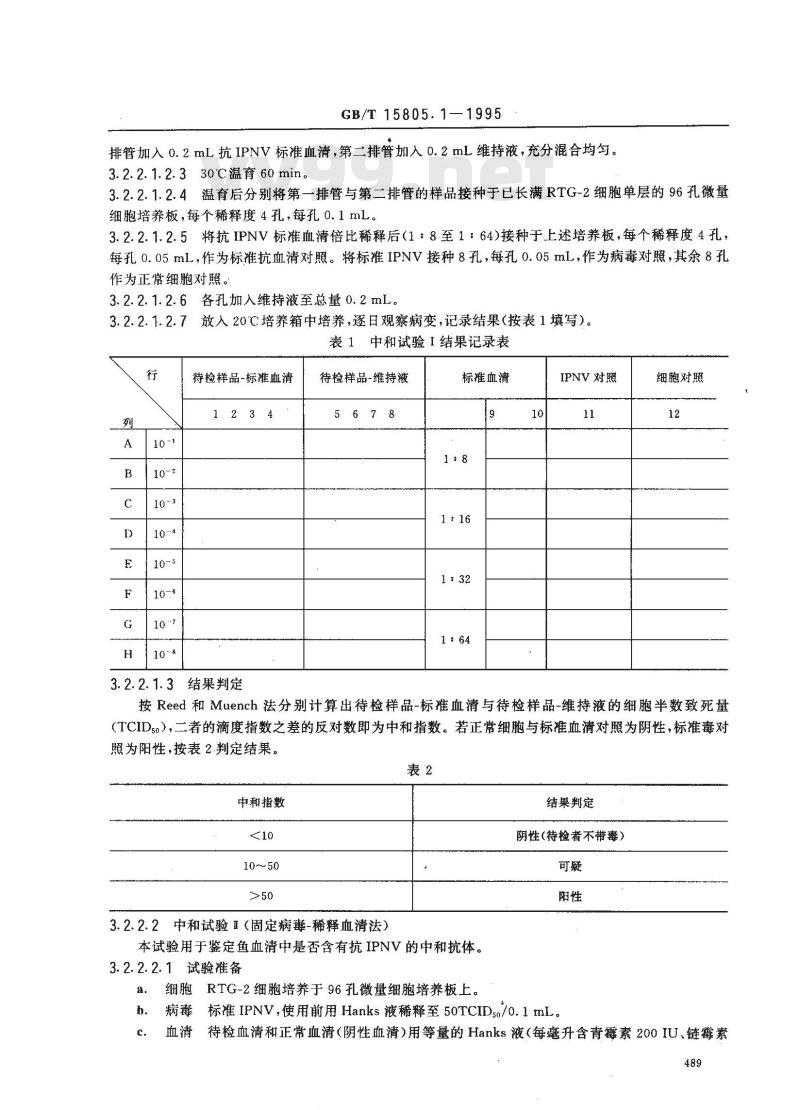
3.2.2.1.2.6各孔加入维持液至总量0.2mL3.2.2.1.2.7放入20℃培养箱中培养,逐日观察病变,记录结果(按表1填写)。表1中和试验1结果记录表
待检样品-标准血清
3.2.2.1.3结果判定
待检样品-维持液
标准血清
IPNV 对照
细胞对照
按Reed和Muench法分别计算出待检样品-标准血清与待检样品-维持液的细胞半数致死量(TCID5o),二者的滴度指数之差的反对数即为中和指数。若正常细胞与标准血清对照为阴性,标准毒对照为阳性,按表2.判定结果。
中和指数
10~50
3.2.2.2中和试验I(固定病-稀释血清法)本试验用于鉴定鱼血清中是否含有抗IPNV的中和抗体。3.2.2.2.1试验准备
RTG-2细胞培养于96孔微量细胞培养板上病毒
结果判定
阴性(待检者不带毒)
标准IPNV,使用前用Hanks液稀释至50TCID5/0.1mL。待检血清和正常血清(阴性血清)用等量的Hanks液(每毫升含青霉素200IU、链霉素489
GB/T15805.1—1995
200mg)稀释后,于45℃灭活30min,待冷却后使用。3.2.2.2.2操作步骤
3.2.2.2.2.1将已灭活处理的待检血清,用Hanks液作系列倍比稀释,使其稀释度由1:4到1:256,每管含量为0.2mL。
3.2.2.2.2.2分别在上述各管中加入0.2mL(即为待检清等量)的50TCIDso/0.1mL的IPNV悬液,充分摇匀混合。
3.2.2.2.2.3于30℃C温育60 min。3.2.2.2.2.4取出后分别接种于长满RTG-2细胞单层的96孔微量细胞培养板,每个稀释度4孔,每孔 0. 1 mL
3.2.2.2.2.5按上述步骤设立正常血清对照;将标准IPNV悬液连续10倍稀释后(10-1~10-7)接种上述培养板,每稀释度4孔,每孔0.1mL,作病毒悬液毒力滴度对照;96孔微量细胞培养板H排12孔作为正常细胞对照。
3.2.2.2.2.6
各孔加入细胞维持液至总量0.2mL。3.2.2.2.2.7放入20℃培养箱培养,逐日观察病变,记录结果(按表3填写)。表3中和试验I结果记录表
1:16
1:128
G1: 256
H细胞对照
待检血
3.2.2.2.3结果判定
正常血清对照
病毒滴度对照
根据病变用Reed-Muench法或Karber法计算出血清中抗体效价(即能保护50%的细胞培养孔不产生病变的最高血清稀释度)。血清中和抗体效价大于或等于1:16者为阳性,小于1:16者为阴性。3.3综合判定
坏死病。
若出现上述临床症状,经细胞培养又出现CPE,并经中和试验为阳性者可判定患有传染性胰b.若无临床症状,但经细胞培养出现 CPE,并经中和试验为阳性者判定为IPNV携带者。若中和试验为可疑,则判定为可疑。c.
d.若无临床症状,经细胞培养也不出现CPE,但鱼血清中抗IPNV中和抗体为阳性者,则判定在近期内患过传染性胰坏死病。
e.著仅有临床症状,或仅能在细胞培养中出现 CPE,但不能被抗IPN中和抗体中和者则不能称患有IPN,需进一步作其他病检查。490
GB/T15805.1—1995
4传染性造血器官坏死病(Infectious Hematopoietic Neorosis,简称 IHN)该病病原属弹状病毒。
本病流行于美国、加拿大和日本。主要危害虹鳟、红点马苏大马哈鱼等鲑鳟鱼类的稚鱼,一龄鱼亦有感染的情况。水温15℃以上鱼呈无症状带毒状态,鱼卵也可带毒。4.1临床检查
4.1.1活动情况
病鱼最初游动迟缓,无力地随水漂浮着,接着顺水流摇晃地游着,虽有痉挛似地动作,但不久就上浮,横着身子而且时常急剧地游泳,不久就死亡。这期间所见狂奔动作为本病的一个特征。4.1.2外部检查
病鱼体色暗黑,肛门通常拖着一条半透明的粪便,亦是该病的一个特征。腹部有腹水且肿胀,眼球突出。贫血,鳃显著褪色。从胸鳍基部、背鳍一~直到前部,以及肛门附近的躯干肌肉常有出血现象,口腔壁亦有出血点。具有卵黄的仔鱼卵黄囊出血,内充满浆液而肿胀。4.1.3剖检
脾、肾坏死,脾脏和幽门垂四周的脂肪组织、腹膜、脑和围心膜等处常有出血点,肠道也有出血现象。4.2实验室检验
4.2.1病毒分离
4.2.1.1细胞准备
同3.2.1.1条,不同的是传染性造血器官坏死病病毒(IHNV)除可用CHSE-214细胞分离外,最适分离病毒细胞是FHM,培养温度28℃。4.2.1.2样品接种
同3.2.1.2条。
4.2.1.3病毒培养
IHNV培养温度是15℃,在培养过程中每日观察细胞变化情况,观察7d结束。4.2.1.4结果观察
若接种样品含有病毒,则3~5d后出现CPE,细胞聚集成族,似葡萄样,然后崩解。若出现CPE,则冻融一次后,低速离心除去细胞碎片,上清液作病鉴定。若7d内无CPE,则为阴性结果。
若7d出现可疑CPE现象,则将该瓶培养液作接种材料再接种一次,以判断是否有CPE。4.2.2病毒鉴定
同 3. 2. 2,不同的是用 IHN 标准毒和 IHN 标准抗血清。用 FHM 或 CHSE 细胞,病毒培养温度是15℃。
4.3综合判定
同3.3条。
5 病毒性出血性败血病(Viral Hemorrhagic Septicemia,简称 VHS)该病病原属弹状病毒。
本病是欧洲地方病。
主要危害虹鳟全长5cm左右的稚鱼到体重200~300g左右食用鱼。症状分三型:急性型见流行早期,症状发展很快,死亡率高。慢性型在流行初期以后可见,症状发展慢,鱼体各部的出血不象急性型那样显著,死亡率低。神经型见流行未期。5.1临床检查
5.1.1活动情况
GB/T 15805.1—1995
流行后期病鱼有时在水里扭转游动,有时侧游,有时又突然向前猛烈游动。5.1.2外部检查
病鱼体色暗黑,眼球突出,腹部膨胀,贫血,鳃、鳍基部、眼和眼眶等处出血。5.1.3剖检
肌肉、内脏脂肪组织、和肠等处出血,以急性型显著。神经型看不出特异的病变。5.2实验室检验
5.2.1病毒分离
5.2.1.1细胞准备
同 3.2.1.1。VHS用RTG-2细胞分离。5.2.1.2样品接种
同3.2.1.2条。但一般不抽取血清样品作抗体检测,因鱼血清抗VHSV中和抗体是补体依赖型,在无补体情况下检测不出中和抗体。5.2.1.3病毒培养
置15C培养,在培养过程中每日观察细胞变化情况,观察7d结束。5.2.1.4结果观察
若接种材料含有病毒,RTG-2细胞在pH7.6的条件下,2~4d后出现 CPE,细胞缩短,然后变成球形,不久就坏死从瓶壁脱落。
若出现CPE,则冻融一次后,低速离心除掉细胞碎片,上清液作病毒鉴定。若7d内无CPE,则为阴性结果。
若 7 d内出现可疑 CPE,则将该瓶细胞培养液作为接种材料再接种一次,以判断是否有 CPE。5.2.2病毒鉴定
对于VHS鉴定,仅对在细胞培养中出现了CPE的样品鉴定是否为VHS病薄,其方法同3.2.2.1。抗血清改为抗 VHS 的标准血清。用 RTG-2细胞,病毒培养温度是15℃。5.3综合判定
a.若出现上述临床症状,经细胞培养又出现CPE,并经中和试验为阳性者可判定患有病毒性出血性败血症。
b.若无临床症状,但经细胞培养出现 CPE,并经中和试验为阳性者则判定为 VHS病毒携带者。c。若中和试验为可疑,则判定为可疑。d、若仅有临床症状,或仅能在组织培养中出现 CPE,但不能被抗VHS 血清所中和者,不能称患有VHS,需进一步作其他病检查。6 斑点义尾鲫病毒病(Channel Catfish Virus Disease,简称 CCVD)该病病原属疱疹病毒。
本病流行于美国。
对鱼龄8个月内的斑点叉尾是一种急性传染病,死亡率可达100%。鱼龄8个月以上的则呈带毒状态。
6.1临床检查
6.1.1活动情况
病鱼游泳异常,又旋转、又抽搐,不久便沉入水底,接着垂直地浮于水面,最终死亡。6.1.2外部检查
病鱼眼球突出,鳃显著褪色。皮肤和鳍有出血现象。晚期病鱼一般腹部膨胀,肛门突出。6.1.3剖检
GB/T15805.1—1995
胃扩张,内有粘液状液体。肌肉、肾、肝、脾等处可见出血。6.2实验室检验
6.2.1病毒分离
6.2.1.1细胞准备
同3.2.1.1条,不同的是CCVD病毒用BB细胞分离,最适培养温度是25~30℃。6.2.1.2样品接种
同3.2.1.2条。
6.2.1.3病毒培养
CCVD病毒培养温度25C,在培养过程中每日观察细胞变化情况,观察7d结束。6.2.1.4结果观察
若接种材料中含有病毒,则1~3d内即可出现CPE,开始出现合胞体,继而细胞崩解。出现CPE的细胞上清液可作病毒鉴定。
7 d内无CPE为阴性结果。
若7d内出现可疑CPE现象,则将该瓶细胞培养液作为接种材料再接种-次,以判断是否有CPE。6.2.2病毒鉴定
同3.2.2条。用CCVD标准毒和CCVD的标准抗血清。用BB细胞,病毒培养温度是25C。6.3综合判定
同3.3条。
7鲤春病毒病(SpringViremiaofCarp,简称SVC)该病病原属弹状病毒。
本病流行于欧洲。
危害一龄以上的鲤鱼。
7.1临床检查
7.1.1活动情况
病鱼集中在进水口,虽进行缓慢地呼吸,但不久便沉入水底。7.1.2外部检查
病鱼体色暗黑,眼球突出,腹部膨胀,肛门发红,肿胀。鳃有出血点。7.1.3剖检
打开体腔,有腹水。肠道有严重炎症。几乎所有内脏都有出血点,壁是最常见的部位,肌肉亦由于出血而发红。脾脏显著肿大。亦可见黄胆症状。此外也可见内脏诸器官水肿。7.2实验室检验
7.2.1病毒分离
7.2.1.1细胞准备
同3.2.1.1条。SVC病毒用FHM细胞分离。7.2.1.2样品接种
同3.2.1.2条。但般不取鱼卵作病毒分离。7.2.1.3病毒培养
SVC病毒最适培养温度是20~22C,在培养过程中,每日观察细胞变化情况,观察7d结束。7.2.1.4结果观察
若接种材料含有病毒,则2~4 d内可出现 CPE,特征为细胞变圆,继而崩解脱落。其他同3.2.1.4条。
7.2.2病毒鉴定
GB/T15805.1—1995
同3.2.2条。用SVC标准毒和抗SVC的标准抗血清。用FHM细胞,病毒培养温度是20~22C。7.3综合判定
同3.3条。
8 疮病(Furunculosis)
该病病原是灭鲑气单胞菌(Aeromonassalmonicida)。本病流行于欧洲、美国、加拿大和日本等国,流行范围较广。主要危害鲑科高龄鱼。一般分三型:急性型,病鱼急性死亡,外部无症状;亚急性型,病情发展较慢,在躯干肌肉形成感染病灶一疮;慢性型,病鱼长期处于带菌状态。8.1临床检查
8.1.1活动情况
病鱼离群独游,活动缓慢。
8.1.2外部检查
病鱼体色暗黑,躯干部有膨隆或溃疡患处。鳍基部充血,通常鳃部亦多数有出血点。8.1.3剖检
肠道充血发炎,肾脏软化、肿大,脾脏亦肿大,多呈淡红色,也有暗红色,肝脏一般褪色,脂肪增多。8.2实验室检验
8.2.1细菌检查
8.2.1.1细菌检查原理
灭鲑气单胞菌在PBG培养基上生长并形成黄色菌落;在FA培养基上生长良好,产生褐色水溶性色素;菌体不运动;大多数菌株V-P反应阴性。利用这些特性可以检查灭鲑气单胞菌的存在。8.2.1.2准备
a.设备和器械
显微镜(具油镜、暗视野)、恒温箱、接种环、培养皿等。b。培养基和试剂
PBG培养基、2%琼脂、FA培养斜面、葡萄糖蛋白陈水、革兰氏染色液I、I、I、V、V-P试剂L配制方法见附录B(补充件)]。
8.2.1.3检验
8.2.1.3.1用解剖刀切开躯干疑为疮的患部(坏死组织已外露时不必切开)。用干净的载玻片紧贴病灶并挤压,取下载玻片后滴加1~2滴无菌水至载玻片上,盖好盖玻片,用400~600倍暗视野显微镜观察菌体运动与否及菌体形态。
8.2.1.3.2可用锥子或解剖针刺穿头骨,破坏小脑,使鱼失去运动能力,再用酒精棉球擦净、消毒被检鱼体表,在肛门前面0.5cm处用无菌剪刀剪开腹部,然后从此处沿一侧向背部逐步转向头部剪成弧形,打开腹腔,露出肾脏。
8.2.1.3.3取肾脏0.5g放入无菌培养Ⅲ内,用无菌玻棒磨碎肾脏,再倾入45~48℃的PBG培养基15mL与之混合均匀,待凝固稍干后加入45℃2%琼脂覆盖,琼脂凝固后把培养血倒置在25℃培养箱内培养 48 h。
8.2.1.3.4用接种环刺破PBG培养皿表面的琼脂层。挑起菌落接种到FA斜面上,置22℃恒温箱中培养72h,观察有无水溶性褐色色素产生。每个培养血出现3个以上黄色菌落时选取3个,3个以下时全部接至FA斜面,每个菌落分别接种一支斜面。8.2.1.3.5选厚薄在1.0~1.2mm的干净载玻片一块,滴1~~2滴无菌水至载玻片上,用接种环挑取在FA斜面.上培养13~24h的细菌少许涂抹在水滴中,加盖玻片用400~600倍暗视野显微镜观察是否运动。
GB/T15805.1—1995
另取一干净载玻片,滴1~2滴无菌水,用接种环挑取同一斜面上的菌苔少许涂片,干燥后在火焰上通过三次固定。革兰氏染色液I液染1min,I液染2min。Ⅱ液脱色至酒精刚刚不出现紫色为止,V液染1~2 min。用油镜观察染色特性和形态。8.2.1.3.6V-P试验。用接种环从FA斜面上挑取培养18~24h菌苔少许接种到葡萄糖蛋白陈水中,置25C培养72h后加入与培养液等量的V-P试剂,放回25℃保温6h后观察。8.2.1.3.7检验项目按下列规则免检。躯干若无肉眼可见疮病灶则不做8.2.1.3.1检验。在8.2.1.3.1中,检出不运动短杆菌时不做8.2.1.3.2~8.2.1.3.6检验。在8.2.1.3.3的检验中,PBG培养血上没有菌落或没有出现黄色菌落时不做8.2.1.3.4~8.2.1.3.6检验。
8.2.1.4结果观察
菌体运动和形态的观察。观察菌体运动的载玻片上的水不能干凋。在暗视野中,菌体活动范围a.
超过视野的1/4,称为具运动性,菌体原地作布朗运动不能称为运动或具运动性。革兰氏染色后,显微镜下看到红色菌体为革兰氏阴性细菌。细菌呈紫色为阳性细菌,菌体颜色不易辩别时,应重新检查一次染色特性,革兰氏染色的灭鲑产气单胞菌,菌体大约为0.8~1.2μm×1.0~1.8μm称短杆菌。
b.在PBG.培养皿上出现的黄色菌落有大有小,均按黄色菌落处理,转接FA斜面时选取较小的菌落,当没有出现菌落或不是黄色菌落时即认定没有疮病。c.在FA斜面上有褐色色素渗入培养基中时为产生水溶性褐色色素,仅菌苔有色素而未渗入培养基中不算作产生水溶性色素。d.V-P试验,加入V-P试剂后6 h观察,红色为阳性,黄色为阴性。8.3综合判定
a.临床检查发现鱼体躯干一处(少数鱼可能多处)有红肿、隆起或局部软化,组织坏死等明显病灶,并检出不运动短杆菌即可判定为病疮病。b.凡检出肾脏有细菌,细菌在PBG培养血上呈黄色菌落,菌体为革兰氏阴性短杆菌,不运动,在FA.斜面上产生水溶性褐色色素,V-P试验阴性,无论有无肉眼可见病症都可判定为疮症。9弧菌病(Vibriosis)
该病病原菌大多数是鳗弧菌(Vibrioanguillarum)。本病流行于欧洲、美国、加拿大和日本等国。等。
弧菌属细菌对淡水鱼、半咸水鱼、海水鱼均有一定的致病力,危害多种鱼类,如鲑科鱼类、香鱼、鳗9.1临床检查
9.1.1活动情况
病鱼活动迟钝,在池边和水面缓慢游动。9.1.2外部检查
鱼的种类不同出现的症状有差异。a.虹:在躯千的任一部位的皮下或肌肉形成一个比较大的类似疮的溃疡,形状不规则,伴有出血,其他地方肌肉也常有出血点。眼球突出,鳃、眼球以及各鳍也出血,肛门发红,往往混有血液的粘液流出。
b.鳗:皮肤点状出血、发红。腹部、下颚和各鳍最为明显,尤以胸鳍严重,往往坏死糜烂。c。香鱼:在躯干任一部位的肌肉内出现-一个半透明的白斑,溃疡患部同时伴有出血。9.1.3剖检
GB/T15805.1---1995
剖检弧菌病病鱼可见到下列症状的全部或部分。肠有炎症,肠管充血或出血,内有黄褐色粘液物,肠内壁有肉眼可见的溃疡。肝脏瘀血、肿大、有出血点或出血斑。9.2实验室检验
9.2.1细菌检查
9.2.1.1准备
设备和器械
同8.2. 1.2中a。
b.培养基和试剂免费标准vv99.net
TYE培养基、糖发酵培养基、革兰氏染色液、1%溴麝香草酚蓝酒精溶液、1%α-萘酚酒精溶液、1%盐酸二甲基对苯撑二胺水溶液、弧菌抑制素0/129试纸片、3%~10%过氧化氢溶液[配制方法见附录C(补充件)门。
9.2.1.2检验
9.2.1.2.1取样:病鱼体表溃疡已深入真皮层时,一般直接用接种环从患部取样在TYE平Ⅲ上划线。体表无溃疡或体表浅溃疡时,可以无菌操作打开腹腔剪下一块肝脏或肾脏组织至TYE平血上,用接种环压-下组织块再在平血上划线。9.2.1.2.2倒置划线的平皿,25℃恒温箱培养24h后,挑选单个菌落转接至TYE斜面上。9.2.1.2.3取TYE斜面上25℃培养18~24h的菌苔作下列检验:a.菌体运动性、染色特性和形态的观察。具体操作见8.2.1.3.5。
b.糖发酵试验。用接种环挑取菌苔少许接至糖发酵培养基中,于.25℃,经24h后观察。c.氧化酶试验。在干净的培养皿中放一张滤纸,滴少许1%二甲基对苯撑二胺水溶液,使滤纸湿润,再滴加约等量的1%α-萘酚溶液,用铂金接种环或玻璃棒或木棒(不能用含铁的铬钼丝接种环)挑取少许菌苔在滤纸上涂抹。
d.过氧化氢酶试验。用接种环挑取一环菌苔涂于干净载玻片上,然后滴加一滴3%~10%过氧化氢溶液。
e.用接种环挑取菌苔在TYE平Ⅲ上均匀涂布,再把漫过弧菌抑制素0/129的小圆试纸片贴在涂布区的中央,倒置平血,于25℃经18~24h后观察。9.2.1.3结果观察
a.仔细察看细菌在TYE平Ⅲ上的菌落的颜色、形态、光泽、菌体运动情况,菌体形态及革兰氏染色特性,并作好记录。
b.糖发酵培养24 h后的培养基由蓝色变为黄色是阳性,表明利用葡萄糖。小套管中有气体为产气,小套管中充满培养基无气体为不产气。滤纸上涂抹菌苔后10s内变为蓝色者为阳性,10~60s内变为蓝色者为迟缓反应,60s以上出现蓝色者为阴性。
滴加过氧化氢后有小气泡冒出为过氧化氢酶阳性,不冒气泡者为阴性。d。试纸片周围一圈无细菌生长为敏感(即阳性),有细菌生长为不敏感。9.3综合判定
a。发现鱼群中有病鱼皮肤出现溃疡,体表有出血点或出血斑,剖检发现肠管有炎症或肝脏瘀血等症状应拟为弧菌病。
b.凡从体表溃疡部或肝肾检出的细菌具有下列特性判定为孤菌病。在TYE平Ⅲ上菌落灰白至淡黄褐色,半透明,正圆隆起,周缘光滑,有光泽。菌体为革兰氏阴性短杆菌,直或稍弯曲,发酵葡萄糖,但不产气。氧化酶阳性,过氧化氢酶阳性,对弧菌抑制素0/129敏感。496
10昏眩病(Whirling Disease)GB/T 15805.11995
该病病原体为脑粘体虫(Myxosomacerebralis)。本病流行于欧洲、美国、加拿大、新西兰、南美和非洲一些国家,流行范围很广。主要是鲑鱼类的疾病。
10. 1 临床症状
2~8月龄的病鱼,尾部露出水面作旋转运动狂游,旋转角度达180~360℃。尾部呈黑色。昏眩病后期鳃盖骨萎缩,鳃裸露在外,下颌骨畸形,脊椎弯曲,眼后头盖骨严重凹陷,这种鱼三年后尚带有病原体。
10.2寄生虫检查
10.2.1采样
选择有临床症状的鱼作寄生虫检查,若无症状,可根据鱼的数量抽样检查。1000尾以下抽检4尾,1000尾以上抽检5~10尾。
10.2.2检查方法
脑粘体虫的孢子大小为6.5~7μm×7.5~8μm,壳面观呈椭圆形至圆形,有两个梨形极囊,孢质中有两个圆形的胚核,无嗜碘泡,感染后三个月左右形成胞囊。10.2.2.1将头部纵切开,观察耳区软骨组织中有无胞囊(乳白色,直径为1~2mm),若有胞囊,取一小块胞囊放在载玻片上,压碎,用450~~600倍显微镜检查,可见到大量脑粘体虫孢子。10.2.2.2如果没有发现胞囊,则从耳石区将软骨组织切开,刮取内含物作涂片镜检。左右耳石区都需检查。
10.2.2.3上述两项检查都未发现孢子,可将鱼的头部割下,并纵切开。放在高速搅拌器内或研钵内,加入20ml蒸馏水,充分搅拌后,取2滴水,放在载玻片上镜检。10.2.2.4孵化后3d的鲑、鳟鱼类就可能感染昏眩病。对于未形成胞囊的病鱼,通过头部软骨组织的病理切片能观察到脑粘体虫的营养体。病理切片按常规切片方法,苏木精、曙红染色。10.3综合判定
出现上述临床症状,又检查到脑粘体虫的孢子或营养体,则判定为昏眩病。a.
b。未出现上述临床症状,但检查到脑粘体虫营养体或孢子,则判定为昏眩病。497
A1细胞生长液
GB/T 15805.1--1995
附录A
细胞生长液等配制方法
(补充件)
称取9.4gEagleMEM\Nissui\溶于1000mL双蒸水中,103.421MPa高压蒸汽灭菌15min,冷却后,在无菌室内,加过滤灭菌的谷氨酰胺0.3g,用10mL的7.5%碳酸氢钠调节pH值为7.2~~7.4,然后分装备用,用前再如10%小牛血清。注:①日本制药株式会社。
A2细胞维持液
含3%~5%的小牛血清细胞生长液为细胞维持液。A3胰酶-EDTA混合消化液
氯化钠(Nacl,分析纯)
氯化钾(KCl,分析纯)
磷酸二氢钾(KH,PO4,分析纯)
磷酸氢二钠(Na2HPO4,分析纯)乙二胺四乙酸(EDTA,分析纯)胰酶(分析纯)
双蒸水
过滤除菌后分装备用。
A4磷酸缓冲盐水(PBS)
氯化钠(NaCI,分析纯)
氯化钾(KC1,分析纯)
氯化钙(CaCl2,分析纯)
氯化镁(MgClz·6HO,分析纯)磷酸氢二钠(NazHPO,·2H2O,分析纯)磷酸二氢钾(KH,PO4分析纯)
双蒸水
1000 ml
103.421MPa,15min高压灭菌,或过滤除菌,普通冰箱保存备用。A57.5%碳酸氢钠
称取碳酸氢钠7.5g(分析纯或化学纯)溶于100mL双蒸水中,然后密封高压灭菌(103.421MPa,15 min)或过滤除菌。
附录B
疮病细菌培养基等溶液的配制方法(补充件)
B1PBG 培养基
蛋白陈(生化试剂)
糖原(生化试剂)
氮化钠(分析纯)
肉浸汁(生化试剂)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
淡水鱼类检疫方法第一部分
The quarantine methods of freshwater fish-Part 11主题内容与适用范围
GB/T 15805.1—1995
本标准规定了淡水鱼类传染性胰坏死病(IPN)、传染性造血器坏死病(IHN)、病毒性出血性败血症(VHS)、斑点叉尾鲫病毒病(CCVD)、鲤春病毒病(SVC)、疗疮病、弧菌病和昏眩病的检疫方法。本标准适用于口岸进口国外淡水鱼类的检疫,也适用于我国国内地区间同种疾病的检疫。2设备和器械
检疫中所用设备和器械除根据各个学科有特殊要求外,均指鱼病实验室常用的设备和器械。3传染性胰坏死病(Infectious Pancreatic Necrosis,简称IPN)该病病原属双链 RNA 病毒。
本病流行于美洲、欧洲和亚洲。主要感染对象是鱼龄6个月以内的虹鳞、美洲红点鲑等鲑鳞鱼类。6个月以上的鱼可以是无症状的带病毒鱼,鱼卵也可携带病毒。3.1临床检查
3.1.1活动情况
病鱼游动失调,常作垂直回转游动,不久便沉入底部死亡。从开始回转游动到死亡的时间为1~2h。在有水流的饲养池中可见失去游泳能力的鱼随水流贴在排水口的拦网上。3.1.2外部检查
病鱼体色暗黑,眼球突出,腹部膨胀。腹壁和鳍基部有出血现象。病鱼多从肛门排出线状粘液样粪便。
3.1.3剖检
除幽门垂出血外,肝脏和脾脏显著褪色,通常消化道内无食物,胃和肠前部积有乳白色粘液而肿胀。3.2实验室检验
3.2.1病毒分离
3.2.1.1细胞准备
a、设备及器械
无菌室、超净工作台、恒温培养箱、低温冰箱(30℃)、液氮罐、赛氏漏斗和0.3,0.45μm混合纤维素酯微孔滤膜、细胞培养瓶、白色橡皮塞等。b.培养基及试剂
细胞生长液、胰酶-EDTA(乙二胺四乙酸)混合消化液、小牛血清、L-谷氨酰胺、碳酸氢钠、酒精。细胞生长液等配制方法见附录A(补充件)。接种前的细胞准备
国家技术监督局1995-12-08批准1996-07-01实施
GB/T15805.1--1995
传染性胰坏死病毒用CHSE-214、RTG-2细胞分离。CHSE-214、RTG-2最适培养温度分别为21℃和20℃。选择生长良好,形成单层的细胞培养物,倒去生长液加入适量胰酶-EDTA混合消化液消化,然后补加生长液,按1:2或1:3的分种率将原瓶消化的细胞分装入2个或3个培养瓶中,置适温中继续培养,当单层致密度达80%左右,即可用于病毒接种。3.2.1.2样品接种
a.设备及器械
同3.2.1.1条a的规定,另增加冷冻离心机和1,2mL规格的移液管。b.常用的溶液
细胞维持液、磷酸缓冲盐水[配制方法见附录A(补充件)]。c.取样
有症状的鱼,取10尾以上样品作病毒分离用。无症状的鱼,取60尾以上样品作病毒分离用。对鱼卵,取60~100粒样品作病毒分离用。对于少量进出口成鱼,从尾动脉抽1~2 mL血液,其血浆作病毒分离用,血清作抗体检测。d.样品处理
较大的鱼取其肾、肝、脾。仔、稚鱼取鱼体全部,若是带卵黄襄的鱼应去掉卵黄囊。鱼卵则取全卵。将上述待检样品称重,加磷酸缓冲盐水(PBS)匀浆,并稀释成10-1,离心30min(4000r/min),弃去沉淀物,将上清液通过0.45μm微孔滤膜除菌,然后再用PBS进行10倍稀释,即成样品。血液样品置于常温下1h后,再放在4℃下12h以上,以析出血清。然后低速离心,其沉淀作待检样品,按上述方法制备样品液,血清作中和试验。e.接种细胞
倒出细胞瓶中的培养液,然后接种样品液,接种量为维持液的10-1,吸附1h后,加细胞维持液培养,同时设对照。
3.2.1.3病毒培养
传染性胰坏死病病(IPNV)培养温度是15~20℃。在培养过程中每日观察细胞变化情况,观察7d结束。
3.2.1.4结果观察
若接种样品含有病毒,培养2~5d后,即出现明显的细胞致病变作用(CPE),主要特征为细胞崩解,细胞单层破坏。收集阳性细胞悬液,冻融一次后,低速离心除去细胞碎片,上清液作病毒鉴定用。若接种后7d仍未见CPE,则判断为阴性结果。若?d内出现可疑CPE现象,则需将该瓶细胞培养液作为接种材料再接种一次,以判断是否有CPE。
3.2.2病毒鉴定
3.2.2.1中和试验【(固定血清用量——稀释病毒法)本试验用于鉴定在细胞培养中出现了CPE的样品是否为IPNV。3.2.2.1.1试验准备
细胞RTG-2细胞培养于 96 孔微量细胞培养板上。a
病毒用标准IPNV毒株,传代后制成病毒悬液。b.
标准抗血清抗IPNV的标准血清,使用前于 56℃灭活60min。c.
d.待检样品(出现了CPE的细胞培养物)冻融一次,除去细胞碎片后使用。3.2.2.1.2操作步骤
3.2.2.1.2.1将待检样品用Hanks液作系列稀释,使其稀释度由10-1到10-3,每管含量为0.5mL。3.2.2.1.2.2取两排试管,分别从上述各稀释度的待检样品中取出0.2mL于两排试管中,然后第一488
GB/T15805.1—1995
排管加入0.2mL抗IPNV标准血清,第二排管加入0.2mL维持液,充分混合均匀。3.2.2.1.2.330℃温育60min。
3.2.2.1.2.4温育后分别将第一排管与第二排管的样品接种于已长满RTG-2细胞单层的96孔微量细胞培养板,每个稀释度4孔,每孔0.1mL。3.2.2.1.2.5将抗IPNV标准血清倍比稀释后(1:8至1:64)接种于上述培养板,每个稀释度4孔,每孔0.05mL,作为标准抗血清对照。将标准IPNV接种8孔,每孔0.05mL,作为病毒对照,其余8孔作为正常细胞对照。
3.2.2.1.2.6各孔加入维持液至总量0.2mL3.2.2.1.2.7放入20℃培养箱中培养,逐日观察病变,记录结果(按表1填写)。表1中和试验1结果记录表
待检样品-标准血清
3.2.2.1.3结果判定
待检样品-维持液
标准血清
IPNV 对照
细胞对照
按Reed和Muench法分别计算出待检样品-标准血清与待检样品-维持液的细胞半数致死量(TCID5o),二者的滴度指数之差的反对数即为中和指数。若正常细胞与标准血清对照为阴性,标准毒对照为阳性,按表2.判定结果。
中和指数
10~50
3.2.2.2中和试验I(固定病-稀释血清法)本试验用于鉴定鱼血清中是否含有抗IPNV的中和抗体。3.2.2.2.1试验准备
RTG-2细胞培养于96孔微量细胞培养板上病毒
结果判定
阴性(待检者不带毒)
标准IPNV,使用前用Hanks液稀释至50TCID5/0.1mL。待检血清和正常血清(阴性血清)用等量的Hanks液(每毫升含青霉素200IU、链霉素489
GB/T15805.1—1995
200mg)稀释后,于45℃灭活30min,待冷却后使用。3.2.2.2.2操作步骤
3.2.2.2.2.1将已灭活处理的待检血清,用Hanks液作系列倍比稀释,使其稀释度由1:4到1:256,每管含量为0.2mL。
3.2.2.2.2.2分别在上述各管中加入0.2mL(即为待检清等量)的50TCIDso/0.1mL的IPNV悬液,充分摇匀混合。
3.2.2.2.2.3于30℃C温育60 min。3.2.2.2.2.4取出后分别接种于长满RTG-2细胞单层的96孔微量细胞培养板,每个稀释度4孔,每孔 0. 1 mL
3.2.2.2.2.5按上述步骤设立正常血清对照;将标准IPNV悬液连续10倍稀释后(10-1~10-7)接种上述培养板,每稀释度4孔,每孔0.1mL,作病毒悬液毒力滴度对照;96孔微量细胞培养板H排12孔作为正常细胞对照。
3.2.2.2.2.6
各孔加入细胞维持液至总量0.2mL。3.2.2.2.2.7放入20℃培养箱培养,逐日观察病变,记录结果(按表3填写)。表3中和试验I结果记录表
1:16
1:128
G1: 256
H细胞对照
待检血
3.2.2.2.3结果判定
正常血清对照
病毒滴度对照
根据病变用Reed-Muench法或Karber法计算出血清中抗体效价(即能保护50%的细胞培养孔不产生病变的最高血清稀释度)。血清中和抗体效价大于或等于1:16者为阳性,小于1:16者为阴性。3.3综合判定
坏死病。
若出现上述临床症状,经细胞培养又出现CPE,并经中和试验为阳性者可判定患有传染性胰b.若无临床症状,但经细胞培养出现 CPE,并经中和试验为阳性者判定为IPNV携带者。若中和试验为可疑,则判定为可疑。c.
d.若无临床症状,经细胞培养也不出现CPE,但鱼血清中抗IPNV中和抗体为阳性者,则判定在近期内患过传染性胰坏死病。
e.著仅有临床症状,或仅能在细胞培养中出现 CPE,但不能被抗IPN中和抗体中和者则不能称患有IPN,需进一步作其他病检查。490
GB/T15805.1—1995
4传染性造血器官坏死病(Infectious Hematopoietic Neorosis,简称 IHN)该病病原属弹状病毒。
本病流行于美国、加拿大和日本。主要危害虹鳟、红点马苏大马哈鱼等鲑鳟鱼类的稚鱼,一龄鱼亦有感染的情况。水温15℃以上鱼呈无症状带毒状态,鱼卵也可带毒。4.1临床检查
4.1.1活动情况
病鱼最初游动迟缓,无力地随水漂浮着,接着顺水流摇晃地游着,虽有痉挛似地动作,但不久就上浮,横着身子而且时常急剧地游泳,不久就死亡。这期间所见狂奔动作为本病的一个特征。4.1.2外部检查
病鱼体色暗黑,肛门通常拖着一条半透明的粪便,亦是该病的一个特征。腹部有腹水且肿胀,眼球突出。贫血,鳃显著褪色。从胸鳍基部、背鳍一~直到前部,以及肛门附近的躯干肌肉常有出血现象,口腔壁亦有出血点。具有卵黄的仔鱼卵黄囊出血,内充满浆液而肿胀。4.1.3剖检
脾、肾坏死,脾脏和幽门垂四周的脂肪组织、腹膜、脑和围心膜等处常有出血点,肠道也有出血现象。4.2实验室检验
4.2.1病毒分离
4.2.1.1细胞准备
同3.2.1.1条,不同的是传染性造血器官坏死病病毒(IHNV)除可用CHSE-214细胞分离外,最适分离病毒细胞是FHM,培养温度28℃。4.2.1.2样品接种
同3.2.1.2条。
4.2.1.3病毒培养
IHNV培养温度是15℃,在培养过程中每日观察细胞变化情况,观察7d结束。4.2.1.4结果观察
若接种样品含有病毒,则3~5d后出现CPE,细胞聚集成族,似葡萄样,然后崩解。若出现CPE,则冻融一次后,低速离心除去细胞碎片,上清液作病鉴定。若7d内无CPE,则为阴性结果。
若7d出现可疑CPE现象,则将该瓶培养液作接种材料再接种一次,以判断是否有CPE。4.2.2病毒鉴定
同 3. 2. 2,不同的是用 IHN 标准毒和 IHN 标准抗血清。用 FHM 或 CHSE 细胞,病毒培养温度是15℃。
4.3综合判定
同3.3条。
5 病毒性出血性败血病(Viral Hemorrhagic Septicemia,简称 VHS)该病病原属弹状病毒。
本病是欧洲地方病。
主要危害虹鳟全长5cm左右的稚鱼到体重200~300g左右食用鱼。症状分三型:急性型见流行早期,症状发展很快,死亡率高。慢性型在流行初期以后可见,症状发展慢,鱼体各部的出血不象急性型那样显著,死亡率低。神经型见流行未期。5.1临床检查
5.1.1活动情况
GB/T 15805.1—1995
流行后期病鱼有时在水里扭转游动,有时侧游,有时又突然向前猛烈游动。5.1.2外部检查
病鱼体色暗黑,眼球突出,腹部膨胀,贫血,鳃、鳍基部、眼和眼眶等处出血。5.1.3剖检
肌肉、内脏脂肪组织、和肠等处出血,以急性型显著。神经型看不出特异的病变。5.2实验室检验
5.2.1病毒分离
5.2.1.1细胞准备
同 3.2.1.1。VHS用RTG-2细胞分离。5.2.1.2样品接种
同3.2.1.2条。但一般不抽取血清样品作抗体检测,因鱼血清抗VHSV中和抗体是补体依赖型,在无补体情况下检测不出中和抗体。5.2.1.3病毒培养
置15C培养,在培养过程中每日观察细胞变化情况,观察7d结束。5.2.1.4结果观察
若接种材料含有病毒,RTG-2细胞在pH7.6的条件下,2~4d后出现 CPE,细胞缩短,然后变成球形,不久就坏死从瓶壁脱落。
若出现CPE,则冻融一次后,低速离心除掉细胞碎片,上清液作病毒鉴定。若7d内无CPE,则为阴性结果。
若 7 d内出现可疑 CPE,则将该瓶细胞培养液作为接种材料再接种一次,以判断是否有 CPE。5.2.2病毒鉴定
对于VHS鉴定,仅对在细胞培养中出现了CPE的样品鉴定是否为VHS病薄,其方法同3.2.2.1。抗血清改为抗 VHS 的标准血清。用 RTG-2细胞,病毒培养温度是15℃。5.3综合判定
a.若出现上述临床症状,经细胞培养又出现CPE,并经中和试验为阳性者可判定患有病毒性出血性败血症。
b.若无临床症状,但经细胞培养出现 CPE,并经中和试验为阳性者则判定为 VHS病毒携带者。c。若中和试验为可疑,则判定为可疑。d、若仅有临床症状,或仅能在组织培养中出现 CPE,但不能被抗VHS 血清所中和者,不能称患有VHS,需进一步作其他病检查。6 斑点义尾鲫病毒病(Channel Catfish Virus Disease,简称 CCVD)该病病原属疱疹病毒。
本病流行于美国。
对鱼龄8个月内的斑点叉尾是一种急性传染病,死亡率可达100%。鱼龄8个月以上的则呈带毒状态。
6.1临床检查
6.1.1活动情况
病鱼游泳异常,又旋转、又抽搐,不久便沉入水底,接着垂直地浮于水面,最终死亡。6.1.2外部检查
病鱼眼球突出,鳃显著褪色。皮肤和鳍有出血现象。晚期病鱼一般腹部膨胀,肛门突出。6.1.3剖检
GB/T15805.1—1995
胃扩张,内有粘液状液体。肌肉、肾、肝、脾等处可见出血。6.2实验室检验
6.2.1病毒分离
6.2.1.1细胞准备
同3.2.1.1条,不同的是CCVD病毒用BB细胞分离,最适培养温度是25~30℃。6.2.1.2样品接种
同3.2.1.2条。
6.2.1.3病毒培养
CCVD病毒培养温度25C,在培养过程中每日观察细胞变化情况,观察7d结束。6.2.1.4结果观察
若接种材料中含有病毒,则1~3d内即可出现CPE,开始出现合胞体,继而细胞崩解。出现CPE的细胞上清液可作病毒鉴定。
7 d内无CPE为阴性结果。
若7d内出现可疑CPE现象,则将该瓶细胞培养液作为接种材料再接种-次,以判断是否有CPE。6.2.2病毒鉴定
同3.2.2条。用CCVD标准毒和CCVD的标准抗血清。用BB细胞,病毒培养温度是25C。6.3综合判定
同3.3条。
7鲤春病毒病(SpringViremiaofCarp,简称SVC)该病病原属弹状病毒。
本病流行于欧洲。
危害一龄以上的鲤鱼。
7.1临床检查
7.1.1活动情况
病鱼集中在进水口,虽进行缓慢地呼吸,但不久便沉入水底。7.1.2外部检查
病鱼体色暗黑,眼球突出,腹部膨胀,肛门发红,肿胀。鳃有出血点。7.1.3剖检
打开体腔,有腹水。肠道有严重炎症。几乎所有内脏都有出血点,壁是最常见的部位,肌肉亦由于出血而发红。脾脏显著肿大。亦可见黄胆症状。此外也可见内脏诸器官水肿。7.2实验室检验
7.2.1病毒分离
7.2.1.1细胞准备
同3.2.1.1条。SVC病毒用FHM细胞分离。7.2.1.2样品接种
同3.2.1.2条。但般不取鱼卵作病毒分离。7.2.1.3病毒培养
SVC病毒最适培养温度是20~22C,在培养过程中,每日观察细胞变化情况,观察7d结束。7.2.1.4结果观察
若接种材料含有病毒,则2~4 d内可出现 CPE,特征为细胞变圆,继而崩解脱落。其他同3.2.1.4条。
7.2.2病毒鉴定
GB/T15805.1—1995
同3.2.2条。用SVC标准毒和抗SVC的标准抗血清。用FHM细胞,病毒培养温度是20~22C。7.3综合判定
同3.3条。
8 疮病(Furunculosis)
该病病原是灭鲑气单胞菌(Aeromonassalmonicida)。本病流行于欧洲、美国、加拿大和日本等国,流行范围较广。主要危害鲑科高龄鱼。一般分三型:急性型,病鱼急性死亡,外部无症状;亚急性型,病情发展较慢,在躯干肌肉形成感染病灶一疮;慢性型,病鱼长期处于带菌状态。8.1临床检查
8.1.1活动情况
病鱼离群独游,活动缓慢。
8.1.2外部检查
病鱼体色暗黑,躯干部有膨隆或溃疡患处。鳍基部充血,通常鳃部亦多数有出血点。8.1.3剖检
肠道充血发炎,肾脏软化、肿大,脾脏亦肿大,多呈淡红色,也有暗红色,肝脏一般褪色,脂肪增多。8.2实验室检验
8.2.1细菌检查
8.2.1.1细菌检查原理
灭鲑气单胞菌在PBG培养基上生长并形成黄色菌落;在FA培养基上生长良好,产生褐色水溶性色素;菌体不运动;大多数菌株V-P反应阴性。利用这些特性可以检查灭鲑气单胞菌的存在。8.2.1.2准备
a.设备和器械
显微镜(具油镜、暗视野)、恒温箱、接种环、培养皿等。b。培养基和试剂
PBG培养基、2%琼脂、FA培养斜面、葡萄糖蛋白陈水、革兰氏染色液I、I、I、V、V-P试剂L配制方法见附录B(补充件)]。
8.2.1.3检验
8.2.1.3.1用解剖刀切开躯干疑为疮的患部(坏死组织已外露时不必切开)。用干净的载玻片紧贴病灶并挤压,取下载玻片后滴加1~2滴无菌水至载玻片上,盖好盖玻片,用400~600倍暗视野显微镜观察菌体运动与否及菌体形态。
8.2.1.3.2可用锥子或解剖针刺穿头骨,破坏小脑,使鱼失去运动能力,再用酒精棉球擦净、消毒被检鱼体表,在肛门前面0.5cm处用无菌剪刀剪开腹部,然后从此处沿一侧向背部逐步转向头部剪成弧形,打开腹腔,露出肾脏。
8.2.1.3.3取肾脏0.5g放入无菌培养Ⅲ内,用无菌玻棒磨碎肾脏,再倾入45~48℃的PBG培养基15mL与之混合均匀,待凝固稍干后加入45℃2%琼脂覆盖,琼脂凝固后把培养血倒置在25℃培养箱内培养 48 h。
8.2.1.3.4用接种环刺破PBG培养皿表面的琼脂层。挑起菌落接种到FA斜面上,置22℃恒温箱中培养72h,观察有无水溶性褐色色素产生。每个培养血出现3个以上黄色菌落时选取3个,3个以下时全部接至FA斜面,每个菌落分别接种一支斜面。8.2.1.3.5选厚薄在1.0~1.2mm的干净载玻片一块,滴1~~2滴无菌水至载玻片上,用接种环挑取在FA斜面.上培养13~24h的细菌少许涂抹在水滴中,加盖玻片用400~600倍暗视野显微镜观察是否运动。
GB/T15805.1—1995
另取一干净载玻片,滴1~2滴无菌水,用接种环挑取同一斜面上的菌苔少许涂片,干燥后在火焰上通过三次固定。革兰氏染色液I液染1min,I液染2min。Ⅱ液脱色至酒精刚刚不出现紫色为止,V液染1~2 min。用油镜观察染色特性和形态。8.2.1.3.6V-P试验。用接种环从FA斜面上挑取培养18~24h菌苔少许接种到葡萄糖蛋白陈水中,置25C培养72h后加入与培养液等量的V-P试剂,放回25℃保温6h后观察。8.2.1.3.7检验项目按下列规则免检。躯干若无肉眼可见疮病灶则不做8.2.1.3.1检验。在8.2.1.3.1中,检出不运动短杆菌时不做8.2.1.3.2~8.2.1.3.6检验。在8.2.1.3.3的检验中,PBG培养血上没有菌落或没有出现黄色菌落时不做8.2.1.3.4~8.2.1.3.6检验。
8.2.1.4结果观察
菌体运动和形态的观察。观察菌体运动的载玻片上的水不能干凋。在暗视野中,菌体活动范围a.
超过视野的1/4,称为具运动性,菌体原地作布朗运动不能称为运动或具运动性。革兰氏染色后,显微镜下看到红色菌体为革兰氏阴性细菌。细菌呈紫色为阳性细菌,菌体颜色不易辩别时,应重新检查一次染色特性,革兰氏染色的灭鲑产气单胞菌,菌体大约为0.8~1.2μm×1.0~1.8μm称短杆菌。
b.在PBG.培养皿上出现的黄色菌落有大有小,均按黄色菌落处理,转接FA斜面时选取较小的菌落,当没有出现菌落或不是黄色菌落时即认定没有疮病。c.在FA斜面上有褐色色素渗入培养基中时为产生水溶性褐色色素,仅菌苔有色素而未渗入培养基中不算作产生水溶性色素。d.V-P试验,加入V-P试剂后6 h观察,红色为阳性,黄色为阴性。8.3综合判定
a.临床检查发现鱼体躯干一处(少数鱼可能多处)有红肿、隆起或局部软化,组织坏死等明显病灶,并检出不运动短杆菌即可判定为病疮病。b.凡检出肾脏有细菌,细菌在PBG培养血上呈黄色菌落,菌体为革兰氏阴性短杆菌,不运动,在FA.斜面上产生水溶性褐色色素,V-P试验阴性,无论有无肉眼可见病症都可判定为疮症。9弧菌病(Vibriosis)
该病病原菌大多数是鳗弧菌(Vibrioanguillarum)。本病流行于欧洲、美国、加拿大和日本等国。等。
弧菌属细菌对淡水鱼、半咸水鱼、海水鱼均有一定的致病力,危害多种鱼类,如鲑科鱼类、香鱼、鳗9.1临床检查
9.1.1活动情况
病鱼活动迟钝,在池边和水面缓慢游动。9.1.2外部检查
鱼的种类不同出现的症状有差异。a.虹:在躯千的任一部位的皮下或肌肉形成一个比较大的类似疮的溃疡,形状不规则,伴有出血,其他地方肌肉也常有出血点。眼球突出,鳃、眼球以及各鳍也出血,肛门发红,往往混有血液的粘液流出。
b.鳗:皮肤点状出血、发红。腹部、下颚和各鳍最为明显,尤以胸鳍严重,往往坏死糜烂。c。香鱼:在躯干任一部位的肌肉内出现-一个半透明的白斑,溃疡患部同时伴有出血。9.1.3剖检
GB/T15805.1---1995
剖检弧菌病病鱼可见到下列症状的全部或部分。肠有炎症,肠管充血或出血,内有黄褐色粘液物,肠内壁有肉眼可见的溃疡。肝脏瘀血、肿大、有出血点或出血斑。9.2实验室检验
9.2.1细菌检查
9.2.1.1准备
设备和器械
同8.2. 1.2中a。
b.培养基和试剂免费标准vv99.net
TYE培养基、糖发酵培养基、革兰氏染色液、1%溴麝香草酚蓝酒精溶液、1%α-萘酚酒精溶液、1%盐酸二甲基对苯撑二胺水溶液、弧菌抑制素0/129试纸片、3%~10%过氧化氢溶液[配制方法见附录C(补充件)门。
9.2.1.2检验
9.2.1.2.1取样:病鱼体表溃疡已深入真皮层时,一般直接用接种环从患部取样在TYE平Ⅲ上划线。体表无溃疡或体表浅溃疡时,可以无菌操作打开腹腔剪下一块肝脏或肾脏组织至TYE平血上,用接种环压-下组织块再在平血上划线。9.2.1.2.2倒置划线的平皿,25℃恒温箱培养24h后,挑选单个菌落转接至TYE斜面上。9.2.1.2.3取TYE斜面上25℃培养18~24h的菌苔作下列检验:a.菌体运动性、染色特性和形态的观察。具体操作见8.2.1.3.5。
b.糖发酵试验。用接种环挑取菌苔少许接至糖发酵培养基中,于.25℃,经24h后观察。c.氧化酶试验。在干净的培养皿中放一张滤纸,滴少许1%二甲基对苯撑二胺水溶液,使滤纸湿润,再滴加约等量的1%α-萘酚溶液,用铂金接种环或玻璃棒或木棒(不能用含铁的铬钼丝接种环)挑取少许菌苔在滤纸上涂抹。
d.过氧化氢酶试验。用接种环挑取一环菌苔涂于干净载玻片上,然后滴加一滴3%~10%过氧化氢溶液。
e.用接种环挑取菌苔在TYE平Ⅲ上均匀涂布,再把漫过弧菌抑制素0/129的小圆试纸片贴在涂布区的中央,倒置平血,于25℃经18~24h后观察。9.2.1.3结果观察
a.仔细察看细菌在TYE平Ⅲ上的菌落的颜色、形态、光泽、菌体运动情况,菌体形态及革兰氏染色特性,并作好记录。
b.糖发酵培养24 h后的培养基由蓝色变为黄色是阳性,表明利用葡萄糖。小套管中有气体为产气,小套管中充满培养基无气体为不产气。滤纸上涂抹菌苔后10s内变为蓝色者为阳性,10~60s内变为蓝色者为迟缓反应,60s以上出现蓝色者为阴性。
滴加过氧化氢后有小气泡冒出为过氧化氢酶阳性,不冒气泡者为阴性。d。试纸片周围一圈无细菌生长为敏感(即阳性),有细菌生长为不敏感。9.3综合判定
a。发现鱼群中有病鱼皮肤出现溃疡,体表有出血点或出血斑,剖检发现肠管有炎症或肝脏瘀血等症状应拟为弧菌病。
b.凡从体表溃疡部或肝肾检出的细菌具有下列特性判定为孤菌病。在TYE平Ⅲ上菌落灰白至淡黄褐色,半透明,正圆隆起,周缘光滑,有光泽。菌体为革兰氏阴性短杆菌,直或稍弯曲,发酵葡萄糖,但不产气。氧化酶阳性,过氧化氢酶阳性,对弧菌抑制素0/129敏感。496
10昏眩病(Whirling Disease)GB/T 15805.11995
该病病原体为脑粘体虫(Myxosomacerebralis)。本病流行于欧洲、美国、加拿大、新西兰、南美和非洲一些国家,流行范围很广。主要是鲑鱼类的疾病。
10. 1 临床症状
2~8月龄的病鱼,尾部露出水面作旋转运动狂游,旋转角度达180~360℃。尾部呈黑色。昏眩病后期鳃盖骨萎缩,鳃裸露在外,下颌骨畸形,脊椎弯曲,眼后头盖骨严重凹陷,这种鱼三年后尚带有病原体。
10.2寄生虫检查
10.2.1采样
选择有临床症状的鱼作寄生虫检查,若无症状,可根据鱼的数量抽样检查。1000尾以下抽检4尾,1000尾以上抽检5~10尾。
10.2.2检查方法
脑粘体虫的孢子大小为6.5~7μm×7.5~8μm,壳面观呈椭圆形至圆形,有两个梨形极囊,孢质中有两个圆形的胚核,无嗜碘泡,感染后三个月左右形成胞囊。10.2.2.1将头部纵切开,观察耳区软骨组织中有无胞囊(乳白色,直径为1~2mm),若有胞囊,取一小块胞囊放在载玻片上,压碎,用450~~600倍显微镜检查,可见到大量脑粘体虫孢子。10.2.2.2如果没有发现胞囊,则从耳石区将软骨组织切开,刮取内含物作涂片镜检。左右耳石区都需检查。
10.2.2.3上述两项检查都未发现孢子,可将鱼的头部割下,并纵切开。放在高速搅拌器内或研钵内,加入20ml蒸馏水,充分搅拌后,取2滴水,放在载玻片上镜检。10.2.2.4孵化后3d的鲑、鳟鱼类就可能感染昏眩病。对于未形成胞囊的病鱼,通过头部软骨组织的病理切片能观察到脑粘体虫的营养体。病理切片按常规切片方法,苏木精、曙红染色。10.3综合判定
出现上述临床症状,又检查到脑粘体虫的孢子或营养体,则判定为昏眩病。a.
b。未出现上述临床症状,但检查到脑粘体虫营养体或孢子,则判定为昏眩病。497
A1细胞生长液
GB/T 15805.1--1995
附录A
细胞生长液等配制方法
(补充件)
称取9.4gEagleMEM\Nissui\溶于1000mL双蒸水中,103.421MPa高压蒸汽灭菌15min,冷却后,在无菌室内,加过滤灭菌的谷氨酰胺0.3g,用10mL的7.5%碳酸氢钠调节pH值为7.2~~7.4,然后分装备用,用前再如10%小牛血清。注:①日本制药株式会社。
A2细胞维持液
含3%~5%的小牛血清细胞生长液为细胞维持液。A3胰酶-EDTA混合消化液
氯化钠(Nacl,分析纯)
氯化钾(KCl,分析纯)
磷酸二氢钾(KH,PO4,分析纯)
磷酸氢二钠(Na2HPO4,分析纯)乙二胺四乙酸(EDTA,分析纯)胰酶(分析纯)
双蒸水
过滤除菌后分装备用。
A4磷酸缓冲盐水(PBS)
氯化钠(NaCI,分析纯)
氯化钾(KC1,分析纯)
氯化钙(CaCl2,分析纯)
氯化镁(MgClz·6HO,分析纯)磷酸氢二钠(NazHPO,·2H2O,分析纯)磷酸二氢钾(KH,PO4分析纯)
双蒸水
1000 ml
103.421MPa,15min高压灭菌,或过滤除菌,普通冰箱保存备用。A57.5%碳酸氢钠
称取碳酸氢钠7.5g(分析纯或化学纯)溶于100mL双蒸水中,然后密封高压灭菌(103.421MPa,15 min)或过滤除菌。
附录B
疮病细菌培养基等溶液的配制方法(补充件)
B1PBG 培养基
蛋白陈(生化试剂)
糖原(生化试剂)
氮化钠(分析纯)
肉浸汁(生化试剂)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。