高中化学教材中有很多重要的演示或改编实验,就下列提供的几套装置回答有关问题:(一)对于实验装置Ⅰ:(1)用装置Ⅰ完成Al与NaOH溶液反应的实验,并验证生成的气体产物,在b中点燃气体之前,应该先进行验纯,验纯的具体操作为.(2)用装置Ⅰ还可以完成Na与乙醇反应及气体产物的检验实验:Na与乙醇反应,理论上有H2生成,若将燃烧后的小烧杯倒转过来,迅速加入澄清石灰水,振荡,发现石灰水变浑浊,原因是.(二)装置Ⅱ用于探究Cl2的漂白性和氧化性:(3)仪器a的名称为(4)关闭K1、打开K2,D中的现象为.(5)E中
2019-06-24
高中化学教材中有很多重要的演示或改编实验,就下列提供的几套装置回答有关问题:
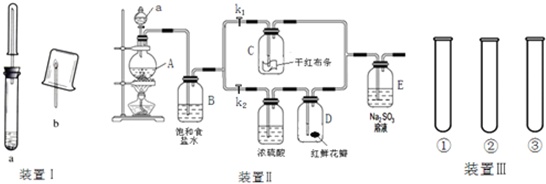
(一)对于实验装置Ⅰ:
(1)用装置Ⅰ完成Al与NaOH溶液反应的实验,并验证生成的气体产物,在b中点燃气体之前,应该先进行验纯,验纯的具体操作为___.
(2)用装置Ⅰ还可以完成Na与乙醇反应及气体产物的检验实验:
Na与乙醇反应,理论上有H2生成,若将燃烧后的小烧杯倒转过来,迅速加入澄清石灰水,振荡,发现石灰水变浑浊,原因是___.
(二)装置Ⅱ用于探究Cl2的漂白性和氧化性:
(3)仪器a的名称为___
(4)关闭K1、打开K2,D中的现象为___.
(5)E中发生反应的离子方程式为___;检验E中有无SO42-生成,用到的试剂有___(填化学式).
(6)整个装置Ⅱ的明显不足之处在于___.
(三)运用装置Ⅲ探究反应速率的影响因素:
(7)该组实验的目的是___;表中V=___
(8)有同学观察实验①过程中产生气泡的快慢,得出以下变化(如图甲):
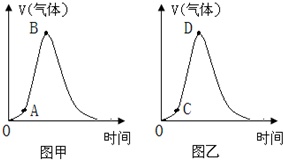
则图甲中AB段变化的主要原因是___;另有别的实验小组在完成Zn粒与稀硫酸反应的实验过程中,观察产生氢气的体积与时间的关系,有类似于图甲的规律,如图乙所示,则CD段变化的主要原因是___.

(一)对于实验装置Ⅰ:
(1)用装置Ⅰ完成Al与NaOH溶液反应的实验,并验证生成的气体产物,在b中点燃气体之前,应该先进行验纯,验纯的具体操作为___.
(2)用装置Ⅰ还可以完成Na与乙醇反应及气体产物的检验实验:
Na与乙醇反应,理论上有H2生成,若将燃烧后的小烧杯倒转过来,迅速加入澄清石灰水,振荡,发现石灰水变浑浊,原因是___.
(二)装置Ⅱ用于探究Cl2的漂白性和氧化性:
(3)仪器a的名称为___
(4)关闭K1、打开K2,D中的现象为___.
(5)E中发生反应的离子方程式为___;检验E中有无SO42-生成,用到的试剂有___(填化学式).
(6)整个装置Ⅱ的明显不足之处在于___.
(三)运用装置Ⅲ探究反应速率的影响因素:
| 试管编号 | 0.01mol/LKMnO4 | 0.5mol/LH2SO4 | 0.2mol/LH2C2O4 | H2O | 褪色时间/s |
| ① | 4mL | 5mL | 2mL | VmL | t1 |
| ② | 4mL | 5mL | 4mL | 7mL | t2 |
| ③ | 4mL | 5mL | 6mL | 5mL | t3 |
(8)有同学观察实验①过程中产生气泡的快慢,得出以下变化(如图甲):

则图甲中AB段变化的主要原因是___;另有别的实验小组在完成Zn粒与稀硫酸反应的实验过程中,观察产生氢气的体积与时间的关系,有类似于图甲的规律,如图乙所示,则CD段变化的主要原因是___.