由短周期元素组成的中学化学常见无机物A、B、C、D存在如图转化关系(部分生成物和反应条件略去)如图1:(1)若D是Na2CO3,则B的电子式可能是.(2)若C为白色沉淀,且A为强碱,写出B与D反应的离子方程式.(3)若A为黑色固体单质,D为常见的液态化合物,且B与D生成C的反应为可逆反应,将不同量的B(g)和D(g)分别通入到体积为2L的恒容密闭容器中,进行反应得到如下三组数据: 实验组 温度 起始量/mol 平衡量/mol 达到平衡所需时间/min B
2019-04-20
由短周期元素组成的中学化学常见无机物A、B、C、D存在如图转化关系(部分生成物和反应条件略去)如图1:
(1)若D是Na2CO3,则B的电子式可能是___.
(2)若C为白色沉淀,且A为强碱,写出B与D反应的离子方程式___.
(3)若A为黑色固体单质,D为常见的液态化合物,且B与D生成C的反应为可逆反应,将不同量的B(g)和D(g)分别通入到体积为2L的恒容密闭容器中,进行反应得到如下三组数据:
①实验1中以v(B)表示的反应速率为___(精确至0.01)
②该反应正向为___(填“吸”或“放”)热反应,实验2条件下平衡常数K=___.
③实验2条件下达到平衡时C的体积分数ω(C)随时间变化如图A(Ⅱ)所示;若改变反应条件,在某条件下ω(C)的变化如图2中的图A中曲线(Ⅰ)所示,则该条件可能是___(填字母).
a、恒容条件下,升高温度
b、恒容条件下,降低温度
c、恒温条件下,缩小反应容器体积
d、恒温条件下,扩大反应容器体积
e、恒温恒容条件下,加入适当催化剂
④若B和D的转化率随
的增加而改变的情况如2中的图B所示,则x=___.

(1)若D是Na2CO3,则B的电子式可能是___.
(2)若C为白色沉淀,且A为强碱,写出B与D反应的离子方程式___.
(3)若A为黑色固体单质,D为常见的液态化合物,且B与D生成C的反应为可逆反应,将不同量的B(g)和D(g)分别通入到体积为2L的恒容密闭容器中,进行反应得到如下三组数据:
| 实验组 | 温度 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| B | D | C | B | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应正向为___(填“吸”或“放”)热反应,实验2条件下平衡常数K=___.
③实验2条件下达到平衡时C的体积分数ω(C)随时间变化如图A(Ⅱ)所示;若改变反应条件,在某条件下ω(C)的变化如图2中的图A中曲线(Ⅰ)所示,则该条件可能是___(填字母).
a、恒容条件下,升高温度
b、恒容条件下,降低温度
c、恒温条件下,缩小反应容器体积
d、恒温条件下,扩大反应容器体积
e、恒温恒容条件下,加入适当催化剂
④若B和D的转化率随
| n(B) |
| n(D) |

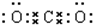 ,故答案为:
,故答案为: