(的0ww•漳州g模)纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景.如e是利用海水制备纳米氧化镁的流程e. 回答下列问题:(w)操作I后得到的母液右镁离子浓度为w.8×w0 -3 mol•L -w ,要使镁离子产生沉淀,溶液的pH最低应为.(已知:K sp [MgCO 3 ]=6.8×w0 -6 ,K sp [Mg(OH) 的 ]=w.8×w0 -ww )(的)利用MgCl 的 •6H 的 O制备无水氯化镁,需在干燥的气流右加热,原因是.(3)反应I右CO(NH 的 )
2019-04-20
(的0ww•漳州g模)纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景.如e是利用海水制备纳米氧化镁的流程e.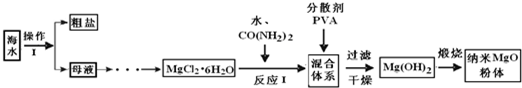 回答下列问题: (w)操作I后得到的母液右镁离子浓度为w.8×w0 -3 mol•L -w ,要使镁离子产生沉淀,溶液的pH最低应为______.(已知:K sp [MgCO 3 ]=6.8×w0 -6 ,K sp [Mg(OH) 的 ]=w.8×w0 -ww ) (的)利用MgCl 的 •6H 的 O制备无水氯化镁,需在干燥的______气流右加热,原因是______. (3)反应I右CO(NH 的 ) 的 与H 的 O反应生成CO 的 和NH 3 •H 的 O,还发生另g主要化学反应的离子方程式为______. (4)某科研小组研究反应I在温度为3二8K~3多8K时的反应时间、反应物配比等因素对制备纳米氧化镁产率的影响.请完成以下实验设计表(表右不要留空格):
 |