“富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H 2 。CO和H 2 可作为能源和化工原料,应用十分广泛。(1)已知:C(s)+O 2 (g)=CO 2 (g) &
2019-11-28
| “富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。  “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H 2 。CO和H 2 可作为能源和化工原料,应用十分广泛。 (1)已知:C(s)+O 2 (g)=CO 2 (g) ΔH 1 =-393.5 kJ·mol –1 ① C(s)+H 2 O(g)=CO(g)+H 2 (g) ΔH 2 =+131.3 kJ·mol –1 ② 则反应CO(g)+H 2 (g) +O 2 (g)= H 2 O(g)+CO 2 (g),ΔH= _________kJ·mol –1 。在标准状况下,33.6 L的煤炭合成气(设全部为CO和H 2 )与氧气完全反应生成CO 2 和H 2 O,反应中转移______mole - 。 (2)在一恒容的密闭容器中,由CO和H 2 合成甲醇:CO(g)+2H 2 (g)  CH 3 OH(g) CH 3 OH(g)①下列情形能说明上述反应已达到平衡状态的是_______ a.体系压强保持不变 b.密闭容器中CO、H 2 、CH 3 OH(g)3种气体共存 c.CH 3 OH与H 2 物质的量之比为1:2 d.每消耗1 mol CO的同时生成2molH 2 ②CO的平衡转化率(α)与温度、压强的关系如图所示。 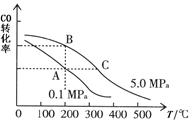 A、B两点的平衡常数_____(填“前者”、“后者”或“一样”)大;达到A、C两点的平衡状态所需的时间t A t C (填“大于”、“小于”或“等于”)。 在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是_____________(答出两点即可)。 (3)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H 2 )作负极燃气,空气与CO 2 的混合气体为正极燃气,用一定比例的Li 2 CO 3 和Na 2 CO 3 低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO + H 2 -4e - + 2CO 3 2 - = 3CO 2 +H 2 O;则该电池的正极反应式为____________。 |