苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:(1)上述生产流程的第一步是“浸泡”,它的实验目的是;(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂;(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是 (按操作的先后顺序填写);【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:晒干海带→浸泡→浸泡液净化→上层清液→酸化→氧化→离子交换树脂吸
2019-11-24
苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:
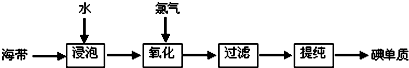
(1)上述生产流程的第一步是“浸泡”,它的实验目的是______;
(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂______;
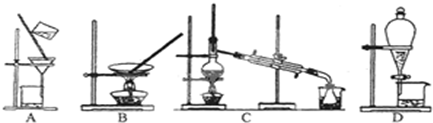
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是______ (按操作的先后顺序填写);
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:晒干海带→浸泡→浸泡液净化→上层清液→酸化→氧化→离子交换树脂吸附→解吸→碘析→精制→成品碘
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化.工业通常不用氯气氧化原因是(用离子方程式表示)______.

(1)上述生产流程的第一步是“浸泡”,它的实验目的是______;
(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂______;
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是______ (按操作的先后顺序填写);

【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:晒干海带→浸泡→浸泡液净化→上层清液→酸化→氧化→离子交换树脂吸附→解吸→碘析→精制→成品碘
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化.工业通常不用氯气氧化原因是(用离子方程式表示)______.