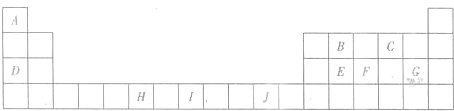
(2011•宝鸡三模)[化学一选修3物质结构与性质]下表为长式周期表的一部分,其中的字母A--J分别代表对应的10种元素.请回答下列问题:(1)元素I的原子结构示意图为.(2)B、E两元素分别与元素C按原子个数比为1:2形成化合物时,中心原子的杂化方式分别为和,这两种化合物的熔沸点差别很大的原因是.(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的.该配离子中含有的化学键类型是,其中G的核外电子排布式为.(4)元素D与元素G形成的化合物DG
2020-02-08
(2011•宝鸡三模)[化学一选修3物质结构与性质]
下表为长式周期表的一部分,其中的字母A--J分别代表对应的10种元素.
请回答下列问题:
(1)元素I的原子结构示意图为______.
(2)B、E两元素分别与元素C按原子个数比为1:2形成化合物时,中心原子的杂化方式分别为______和______,这两种化合物的熔沸点差别很大的原因是______.
 (3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的______.该配离子中含有的化学键类型是______,其中G的核外电子排布式为______.
(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的______.该配离子中含有的化学键类型是______,其中G的核外电子排布式为______.
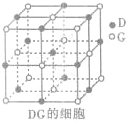
(4)元素D与元素G形成的化合物DG的晶胞结构如图所示,每个D离子周围与之最近的D离子的个数为______.若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该化合物的密度为
g/cm3
g/cm3.
下表为长式周期表的一部分,其中的字母A--J分别代表对应的10种元素.

请回答下列问题:
(1)元素I的原子结构示意图为______.
(2)B、E两元素分别与元素C按原子个数比为1:2形成化合物时,中心原子的杂化方式分别为______和______,这两种化合物的熔沸点差别很大的原因是______.
 (3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的______.该配离子中含有的化学键类型是______,其中G的核外电子排布式为______.
(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的______.该配离子中含有的化学键类型是______,其中G的核外电子排布式为______.(4)元素D与元素G形成的化合物DG的晶胞结构如图所示,每个D离子周围与之最近的D离子的个数为______.若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该化合物的密度为
| 234 |
| a3NA |
| 234 |
| a3NA |
 ,
,