CO和H2可作为能源和化工原料,应用十分广泛.制取CO和H2的有关化学反应的能量变化如图3所示.(1)写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式.(2)CO和H2可以合成二甲醚,化学方程式为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H<0.如果上述反应方程式的平衡常数K值变大,则该反应(选填编号).A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小C.一定向
2019-04-04
CO和H2可作为能源和化工原料,应用十分广泛.制取CO和H2的有关化学反应的能量变化如图3所示.
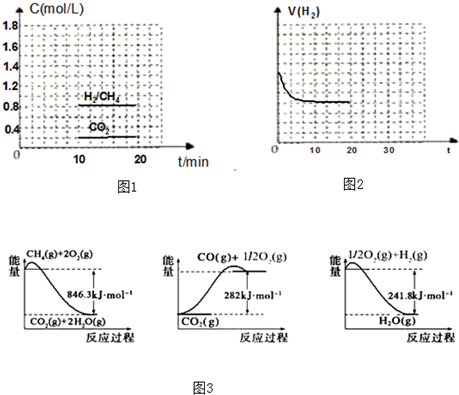
(1)写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式______.
(2)CO和H2可以合成二甲醚,化学方程式为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H<0.
如果上述反应方程式的平衡常数K值变大,则该反应______(选填编号).
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g).
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的浓度如图1所示:用CH4表示达到平衡时的正反应速率______,起始充H2的物质的量为______,该温度下的平衡常数等于______.
②图2表示H2在建立平衡过程中的速率时间图,若现在20min时扩大容器体积,并在30min时又达到状态,请在图2中画出H2的逆反应方向速率时间图象.
优质解答
(1)由图三可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
CO2(g)=CO(g)+O2(g)△H=+282KJ/mol ②
H2(g)+O2(g)=H2O(g)△H=-241.8KJ/mol ③
将①+②-③×3可得:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=(-846.3KJ/mol)+(+282KJ/mol )-(-241.8KJ/mol )×3=+161.1 kJ•mol-1
故答案为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+161.1 kJ•mol-1;
(2)反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H<0,故若使平衡常数K值变大,则平衡右移,必须通过降低温度才能实现.
A、平衡常数K值变大,平衡右移,故A正确;
B、平衡常数K值变大,平衡右移,须降低温度,而降低温度时正反应速率一直减小,故B错误;
C、平衡常数K值变大,平衡右移,故C错误;
D、平衡常数K值变大,平衡右移,须降低温度,而降低温度时逆反应速率开始减小,由于平衡右移,生成物的浓度后来增大,故逆反应速率后来增大,故D正确.
故选AD;
(3)①平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
用CH4表示达到平衡时的正反应速率==0.08 mol•L-1•min-1;
起始充H2的物质的量=4.0mol/L×2L=8mol;
平衡常数K==25;
故答案为:0.08 mol•L-1•min-1; 8 mol; 25;
②CO2(g)+4H2(g)⇌CH4(g)+2H2O(g),反应是气体体积减小的反应,在20min时扩大容器体积,减小压强,反应速率减小,正逆反应速率减小,正反应速率减小的多,反应逆向进行,逆反应速率减小的小,随反应进行氢气逆反应速率减小最后达到平衡状态,氢气的逆反应速率如右图CO2(g)+4H2(g)⇌CH4(g)+2H2O(g),反应是气体体积减小的反应,在20min时扩大容器体积,减小压强,反应速率减小,正逆反应速率减小,正反应速率减小的多,反应逆向进行,逆反应速率减小的小,随反应进行氢气逆反应速率减小最后达到平衡状态,氢气的逆反应速率如右图: ,
,
故答案为: .
(1)由图三可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
.
(1)由图三可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
CO2(g)=CO(g)+O2(g)△H=+282KJ/mol ②
H2(g)+O2(g)=H2O(g)△H=-241.8KJ/mol ③
将①+②-③×3可得:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=(-846.3KJ/mol)+(+282KJ/mol )-(-241.8KJ/mol )×3=+161.1 kJ•mol-1
故答案为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+161.1 kJ•mol-1;
(2)反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H<0,故若使平衡常数K值变大,则平衡右移,必须通过降低温度才能实现.
A、平衡常数K值变大,平衡右移,故A正确;
B、平衡常数K值变大,平衡右移,须降低温度,而降低温度时正反应速率一直减小,故B错误;
C、平衡常数K值变大,平衡右移,故C错误;
D、平衡常数K值变大,平衡右移,须降低温度,而降低温度时逆反应速率开始减小,由于平衡右移,生成物的浓度后来增大,故逆反应速率后来增大,故D正确.
故选AD;
(3)①平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
用CH4表示达到平衡时的正反应速率==0.08 mol•L-1•min-1;
起始充H2的物质的量=4.0mol/L×2L=8mol;
平衡常数K==25;
故答案为:0.08 mol•L-1•min-1; 8 mol; 25;
②CO2(g)+4H2(g)⇌CH4(g)+2H2O(g),反应是气体体积减小的反应,在20min时扩大容器体积,减小压强,反应速率减小,正逆反应速率减小,正反应速率减小的多,反应逆向进行,逆反应速率减小的小,随反应进行氢气逆反应速率减小最后达到平衡状态,氢气的逆反应速率如右图CO2(g)+4H2(g)⇌CH4(g)+2H2O(g),反应是气体体积减小的反应,在20min时扩大容器体积,减小压强,反应速率减小,正逆反应速率减小,正反应速率减小的多,反应逆向进行,逆反应速率减小的小,随反应进行氢气逆反应速率减小最后达到平衡状态,氢气的逆反应速率如右图: ,
,
故答案为: .
.


 ,
,