高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂.M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团).(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol.该金属M的相对原子质量为.将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为mol•L-1.(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入26
2019-11-27
高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂.M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团).
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol.该金属M的相对原子质量为______.
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为______mol•L-1.
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL.将B投入过量烧碱溶液中,未检测出NH3的逸出.则B的化学式可表示为______.
(3)已知在图中,L的位置完全相同.现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似图.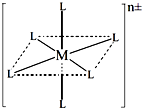
如果该配离子共有2种不同结构,该配离子的式量为______.
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2.则该盐的式量以及物质的量分别为______.
优质解答
(1)设氧化物的化学式为M2OX,与HCl的反应方程式为:M2Ox+2xHCl═2MClx+xH2O,
则有:M2Ox+2xHCl═2MClx+xH2O
(2M+16x)g 2xmol
6.08g (0.6-0.48)mol
n(O元素)=n(H2O)=0.12mol
可知:n(M金属)= mol
m(M金属)=6.08-m(O元素)=6.08-0.12×16=4.16g
M(M金属)=m(M金属)/n(M金属)==
讨论:
当x=1时,M(M金属)=17.33g/mol (元素周期表中没有)
当x=2时,M(M金属)=34.67g/mol (元素周期表中没有)
当x=3时,M(M金属)=52g/mol (金属Cr)
当x=4时,M(M金属)=69.33/mol (元素周期表中没有)
当x=5时,M(M金属)=86.7g/mol (元素周期表中没有)
当x=6时,M(M金属)=104g/mol(与题意不符合)
故只有52符合,为Cr元素,氧化物为Cr2O3,6.08g该氧化物的物质的量为n(Cr2O3)==0.04mol,溶于盐酸生成CrCl3,物质的量为0.08mol,其浓度为:=1.6mol/L,故答案为:52; 1.6;
(2)12.5mL溶液中含离子的物质的量为0.02mol,2688mL氨气的物质的量为:=0.12mol,B含有Cl-离子的物质的量为0.04L×1.5mol/L=0.06mol,能与硝酸银溶液反应,说明Cl为配合物的外界离子,将B投入过量烧碱溶液中,未检测出NH3的逸出.说明NH3和Cr形成配位键,则n(Cr3+):n(NH3):n(Cl-)=1:6:3,故化学式为:[Cr(NH3)6]Cl 3,
故答案为:[Cr(NH3)6]Cl 3;
(3)根据图示,x=2,3,4时才有两种不同结构,所以分别算得式量为:191.0,209.5,228.0,故答案为:
191.0,209.5,228.0;
(4)电子转移守恒(设铬盐中铬元素的化合价为n):2×(n-3)×=4×0.03,可知铬在盐中的化合价为+6,由“盐内部阴阳离子个数比为1:2”,设盐为K2(CrxOy),
因为该物质呈中性,又式量小于360,得到x=1或2,根据阴阳离子电荷相等,求得x:y=1:4或2:7,
即该盐为k2CrO4或k2Cr2O7,式量分别为194,294;
分别设k2CrO4、k2Cr2O7为pmol,qmol,利用钾元素和铬元素守恒,则有:
2p+2q=0.05mol,p+2q=mol,解之得:p=0.01mol,q=0.15mol,故答案为:294、0.015mol;194、0.01mol.
(1)设氧化物的化学式为M2OX,与HCl的反应方程式为:M2Ox+2xHCl═2MClx+xH2O,
则有:M2Ox+2xHCl═2MClx+xH2O
(2M+16x)g 2xmol
6.08g (0.6-0.48)mol
n(O元素)=n(H2O)=0.12mol
可知:n(M金属)= mol
m(M金属)=6.08-m(O元素)=6.08-0.12×16=4.16g
M(M金属)=m(M金属)/n(M金属)==
讨论:
当x=1时,M(M金属)=17.33g/mol (元素周期表中没有)
当x=2时,M(M金属)=34.67g/mol (元素周期表中没有)
当x=3时,M(M金属)=52g/mol (金属Cr)
当x=4时,M(M金属)=69.33/mol (元素周期表中没有)
当x=5时,M(M金属)=86.7g/mol (元素周期表中没有)
当x=6时,M(M金属)=104g/mol(与题意不符合)
故只有52符合,为Cr元素,氧化物为Cr2O3,6.08g该氧化物的物质的量为n(Cr2O3)==0.04mol,溶于盐酸生成CrCl3,物质的量为0.08mol,其浓度为:=1.6mol/L,故答案为:52; 1.6;
(2)12.5mL溶液中含离子的物质的量为0.02mol,2688mL氨气的物质的量为:=0.12mol,B含有Cl-离子的物质的量为0.04L×1.5mol/L=0.06mol,能与硝酸银溶液反应,说明Cl为配合物的外界离子,将B投入过量烧碱溶液中,未检测出NH3的逸出.说明NH3和Cr形成配位键,则n(Cr3+):n(NH3):n(Cl-)=1:6:3,故化学式为:[Cr(NH3)6]Cl 3,
故答案为:[Cr(NH3)6]Cl 3;
(3)根据图示,x=2,3,4时才有两种不同结构,所以分别算得式量为:191.0,209.5,228.0,故答案为:
191.0,209.5,228.0;
(4)电子转移守恒(设铬盐中铬元素的化合价为n):2×(n-3)×=4×0.03,可知铬在盐中的化合价为+6,由“盐内部阴阳离子个数比为1:2”,设盐为K2(CrxOy),
因为该物质呈中性,又式量小于360,得到x=1或2,根据阴阳离子电荷相等,求得x:y=1:4或2:7,
即该盐为k2CrO4或k2Cr2O7,式量分别为194,294;
分别设k2CrO4、k2Cr2O7为pmol,qmol,利用钾元素和铬元素守恒,则有:
2p+2q=0.05mol,p+2q=mol,解之得:p=0.01mol,q=0.15mol,故答案为:294、0.015mol;194、0.01mol.

