正确图象、图表的分析和处理在化学中是一种不可缺少的能力,请分析下列图象、图标,完成相关问题(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.①认真分析如图中同周期元素第一电离能的变化规律,将Na-Ar之间六种元素用短线连接起来,构成完整的图象.②从如图分析可知,同一主族元素原子的第一电离能I1变化规律是;Zn的第一电离能大于Ga的原因是.③上图中5号元素在周期表中的位置是;(2)某些共价键的键能数据如下(单位:kJ/mol)共价键H-HCl-ClBr-BrH-ClH-II-IN≡NH-OH-
2019-04-21
正确图象、图表的分析和处理在化学中是一种不可缺少的能力,请分析下列图象、图标,完成相关问题

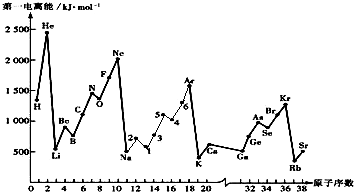
(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
①认真分析如图中同周期元素第一电离能的变化规律,将Na-Ar之间六种元素用短线连接起来,构成完整的图象.
②从如图分析可知,同一主族元素原子的第一电离能I1变化规律是______;Zn的第一电离能大于Ga的原因是______.
③上图中5号元素在周期表中的位置是______;
(2)某些共价键的键能数据如下(单位:kJ/mol)
①把1molCl2分解为气态原子时,需要______(填“吸收”或“放出”)______kJ能量.
②试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)反应中的能量变化:(填“吸收”或“放出”)______kJ能量.

(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
①认真分析如图中同周期元素第一电离能的变化规律,将Na-Ar之间六种元素用短线连接起来,构成完整的图象.
②从如图分析可知,同一主族元素原子的第一电离能I1变化规律是______;Zn的第一电离能大于Ga的原因是______.
③上图中5号元素在周期表中的位置是______;
(2)某些共价键的键能数据如下(单位:kJ/mol)
| 共价键 | H-H | Cl-Cl | Br-Br | H-Cl | H-I | I-I | N≡N | H-O | H-N |
| 键 能 | 436 | 247 | 193 | 431 | 299 | 151 | 946 | 463 | 391 |
②试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)反应中的能量变化:(填“吸收”或“放出”)______kJ能量.
 ;
;