甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”.甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域.已知甲醇制备的有关化学反应如下:反应①:CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.77kJ/mol反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2反应③:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H3=-49.58kJ/mol(1)反应②的△H2=(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=(用K1、K
2019-04-14
甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”.甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域.已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.77kJ/mol
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2
反应③:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H3=-49.58kJ/mol
(1)反应②的△H2=___
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=___(用K1、K2表示).已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正___V逆(填“>”、“=”或“<”)
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图1中曲线I所示.若在t0时刻分别改变一个条件,曲线I变为曲线Ⅱ和曲线Ⅲ.当曲线I变为曲线Ⅱ时,改变的条件是___.当通过改变压强使曲线I变为曲线Ⅲ时,曲线Ⅲ达到平衡时容器的体积为___.
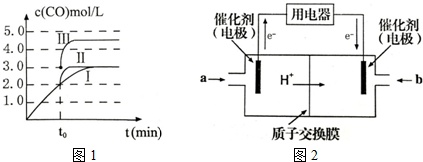
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图2所示,则通入a气体的电极的电极反应式为___
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.常温条件下,将a mol/L的CH3COOH与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___.
反应①:CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.77kJ/mol
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2
反应③:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H3=-49.58kJ/mol
(1)反应②的△H2=___
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=___(用K1、K2表示).已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正___V逆(填“>”、“=”或“<”)
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图1中曲线I所示.若在t0时刻分别改变一个条件,曲线I变为曲线Ⅱ和曲线Ⅲ.当曲线I变为曲线Ⅱ时,改变的条件是___.当通过改变压强使曲线I变为曲线Ⅲ时,曲线Ⅲ达到平衡时容器的体积为___.

(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图2所示,则通入a气体的电极的电极反应式为___
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.常温条件下,将a mol/L的CH3COOH与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___.