新技术的开发离不开新材料,物质结构的研究为新材料的应用奠定了基础.2010、2011年的诺贝尔奖均与物质结构有关,其中2010年的诺贝尔物理学奖颁给了因在二维空间材料石墨烯方面进行了开创性实验的两位英国科学家.如图1是几种晶体的结构图示:请回答有关问题:(1)C的基态原子的电子排布式是:;(2)C60可用作储氢材料.已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?,简述理由;(3)石墨烯可用看做单层的石墨,所有的碳
2019-06-27
新技术的开发离不开新材料,物质结构的研究为新材料的应用奠定了基础.2010、2011年的诺贝尔奖均与物质结构有关,其中2010年的诺贝尔物理学奖颁给了因在二维空间材料石墨烯方面进行了开创性实验的两位英国科学家.如图1是几种晶体的结构图示: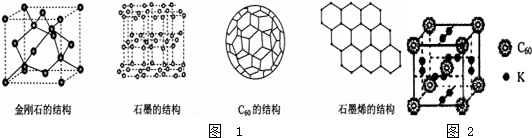
请回答有关问题:
(1)C的基态原子的电子排布式是:______;
(2)C60可用作储氢材料.已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?______,简述理由______;
(3)石墨烯可用看做单层的石墨,所有的碳原子都以单键结合,每个碳原子多余的一个电子用于形成一种特殊的大п键,所以这些形成п键的电子可以在石墨烯中自由运动.下列关于石墨烯的说法不正确的是______;
A.仅有一个碳原子的厚度,如此薄的结晶材料肯定是非常不稳定的
B.具有和金属一样良好的导电、导热性能
C.所有的碳原子均采用sp2杂化
D.由于碳碳原子间以共价键相结合,它的强度应该是非常高的
(4)已知石墨烯中每个碳碳键的键长为142pm,可以计算出平均每个正六边形的面积约为5.24×10-20m2,则12g石墨烯的面积约为______m2;
(5)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,该物质在低温时是一种超导体.其晶胞如图2所示,该物质中K原子核C60分子的个数比为______;
(6)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______;其中Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则每个Si60分子中п键的数目为______.

请回答有关问题:
(1)C的基态原子的电子排布式是:______;
(2)C60可用作储氢材料.已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?______,简述理由______;
(3)石墨烯可用看做单层的石墨,所有的碳原子都以单键结合,每个碳原子多余的一个电子用于形成一种特殊的大п键,所以这些形成п键的电子可以在石墨烯中自由运动.下列关于石墨烯的说法不正确的是______;
A.仅有一个碳原子的厚度,如此薄的结晶材料肯定是非常不稳定的
B.具有和金属一样良好的导电、导热性能
C.所有的碳原子均采用sp2杂化
D.由于碳碳原子间以共价键相结合,它的强度应该是非常高的
(4)已知石墨烯中每个碳碳键的键长为142pm,可以计算出平均每个正六边形的面积约为5.24×10-20m2,则12g石墨烯的面积约为______m2;
(5)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,该物质在低温时是一种超导体.其晶胞如图2所示,该物质中K原子核C60分子的个数比为______;
(6)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______;其中Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则每个Si60分子中п键的数目为______.