(2010•德阳模拟)已知图A-J均为中学化学中常见物质,其中反应①在冶金工业上有重要用途,框图中部分产物已经略去.请回答下列问题:(1)E的电子式为.(2)反应①的化学方程式是2Al+Fe2O3 高温 . 2Fe+Al2O32Al+Fe2O3 高温 . 2Fe+Al2O3.(3)反应⑥的离子方程式是.按上图所示制取白色沉淀J,当生成1mol J时,则反应⑤中消耗HCl的物质的量为mol.(4)以B、C、NaOH溶液为原料构成原电池,则
2019-04-20
(2010•德阳模拟)已知图A-J均为中学化学中常见物质,其中反应①在冶金工业上有重要用途,框图中部分产物已经略去.请回答下列问题:
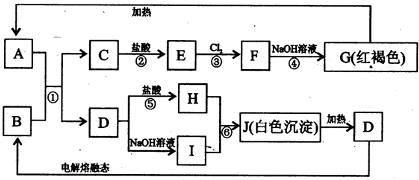
(1)E的电子式为______.
(2)反应①的化学方程式是
(3)反应⑥的离子方程式是______.按上图所示制取白色沉淀J,当生成1mol J时,则反应⑤中消耗HCl的物质的量为______mol.
(4)以B、C、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为:______.

(1)E的电子式为______.
(2)反应①的化学方程式是
2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
.
| ||
(3)反应⑥的离子方程式是______.按上图所示制取白色沉淀J,当生成1mol J时,则反应⑤中消耗HCl的物质的量为______mol.
(4)以B、C、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为:______.
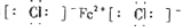 ,
,