(2013•临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.(1)Cu是元素周期表中第29号元素,写出第三周期基态原子未成对电子数与Cu相同且电负性最大的元素是(填元素名称).(2)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:.(3)如图某种氧化物的晶胞示意图.已知该晶胞的边长为a cm,阿伏加德罗常数为NA,该晶体的密度为320a3NAg/cm3320a3NAg/cm3.(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水
 (2013•临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.
(2013•临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.
(1)Cu是元素周期表中第29号元素,写出第三周期基态原子未成对电子数与Cu相同且电负性最大的元素是______(填元素名称).
(2)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:______.
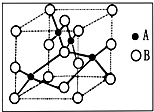
(3)如图某种氧化物的晶胞示意图.已知该晶胞的边长为a cm,阿伏加德罗常数为NA,该晶体的密度为
g/cm3
g/cm3.
(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4•H2O沉淀.
①SO42-中S原子的杂化方式为______.
②NH3分子内的H-N-H键角______(填“大于”“等于”或“小于”)H2O分子内的H-O-H键角.
③S、N、O三种元素第一电离能由大到小的顺序为______.
2019-04-14
 (2013•临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.
(2013•临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.(1)Cu是元素周期表中第29号元素,写出第三周期基态原子未成对电子数与Cu相同且电负性最大的元素是______(填元素名称).
(2)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:______.
(3)如图某种氧化物的晶胞示意图.已知该晶胞的边长为a cm,阿伏加德罗常数为NA,该晶体的密度为
| 320 |
| a3NA |
| 320 |
| a3NA |
(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4•H2O沉淀.
①SO42-中S原子的杂化方式为______.
②NH3分子内的H-N-H键角______(填“大于”“等于”或“小于”)H2O分子内的H-O-H键角.
③S、N、O三种元素第一电离能由大到小的顺序为______.