在化学分析实验中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[M(Na2C2O4)=134.0g•mol-1]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O以下是标定KMnO4溶液的实验步骤:步骤一:先粗配浓度
2019-04-13
在化学分析实验中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[M(Na2C2O4)=134.0g•mol-1]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol•L-1的高锰酸钾溶液500mL.
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在如表中:
试回答下列问题:
(1)步骤一中要用到的主要玻璃仪器除烧杯外还需___.
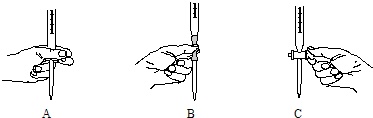
(2)步骤二中滴定操作图示正确的是___(填编号).
(3)从实验所得数据计算,KMnO4溶液的浓度为___ mol•L-1.
(4)如果在滴定过程中滴定管漏液,则测定结果将___(填“偏高”、“偏低”或“无影响”下同),滴定结束后俯视读数,则测定结果将___.
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol•L-1的高锰酸钾溶液500mL.
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在如表中:
| 平行实验编号 | Na2C2O4质量 (m g) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 1.34 | 0.00 | 25.02 |
| 2 | 1.34 | 0.02 | 25.00 |
| 3 | 1.34 | 0.18 | 25.18 |
(1)步骤一中要用到的主要玻璃仪器除烧杯外还需___.
(2)步骤二中滴定操作图示正确的是___(填编号).

(3)从实验所得数据计算,KMnO4溶液的浓度为___ mol•L-1.
(4)如果在滴定过程中滴定管漏液,则测定结果将___(填“偏高”、“偏低”或“无影响”下同),滴定结束后俯视读数,则测定结果将___.