工业废料石膏(CaSO4•2H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等.某研究性学习小组展开了如下系列研究.一、高纯CaO的制备【资料一】Ⅰ.无水硫酸铜遇水变成蓝色的硫酸铜晶体.Ⅱ.石膏(CaSO4•2H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物.Ⅲ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊,还能被高锰酸钾溶液氧化而除去.甲同学用如图1装置制备CaO并验证石膏与焦炭高温反应的其他产物.实验过程中发现:B中无水硫酸铜变蓝,C中产生现象证明有SO2生成,装置中
2019-12-02
工业废料石膏(CaSO4•2H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等.某研究性学习小组展开了如下系列研究.
一、高纯CaO的制备
【资料一】
Ⅰ.无水硫酸铜遇水变成蓝色的硫酸铜晶体.
Ⅱ.石膏(CaSO4•2H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物.
Ⅲ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊,还能被高锰酸钾溶液氧化而除去.
甲同学用如图1装置制备CaO并验证石膏与焦炭高温反应的其他产物.
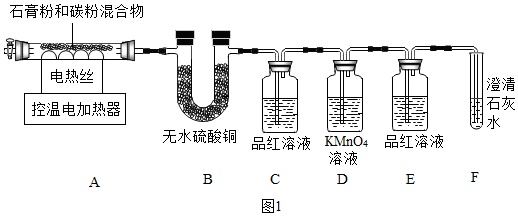
实验过程中发现:B中无水硫酸铜变蓝,C中产生___现象证明有SO2生成,装置___中无明显变化和装置F中___现象证明有CO2生成.写出石膏与碳粉在高温条件下反应的化学方程式:___
二、硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如图2:
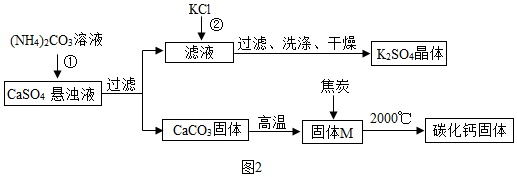
【资料二】氧化钙与焦炭在高温下反应生成碳化钙和一氧化碳.
(1)反应①的化学方程式为___.证明固体M中不含CaCO3的方法
是___(写出实验的方法、现象).
(2)反应②的化学方程式为(NH4)2SO4+2KCl═K2SO4↓+2NH4Cl,该反应能析出K2SO4晶体的原因是___.
(3)假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验.
【资料三】碳化钙在空气中灼烧生成氧化钙和二氧化碳气体.
步骤一:称取3.76g样品于图3所示石英管中(测定装置图如图3,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g.(玻璃纤维可防止固体粉末进入导管)
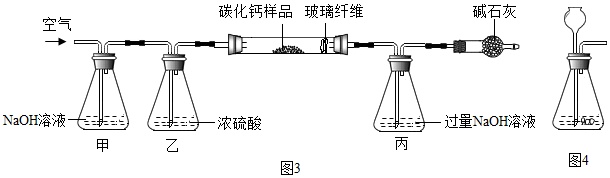
步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克.试回答下列问题:
①装置甲的作用是___.反应完全后继续缓缓通入空气的目的是___.
②根据步骤一、二计算该样品中钙、碳、氧的质量比为___,
计算确定CaCx的化学式(请写出计算过程)
③应用:丙同学经查阅资料知道实验室常用电石(主要成分为碳化钙)与水反应制取乙炔气体(发生装置如图4).经实验发现,电石与水反应非常剧烈,为控制反应的速度以得到平稳的气流,下列改进方法可行的是___
A.改长颈漏斗为分液漏斗或注射器 B.将电石研成粉末
C.将锥形瓶置于冰水浴中 D.用饱和食盐水代替水(电石与氯化钠不反应)
一、高纯CaO的制备
【资料一】
Ⅰ.无水硫酸铜遇水变成蓝色的硫酸铜晶体.
Ⅱ.石膏(CaSO4•2H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物.
Ⅲ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊,还能被高锰酸钾溶液氧化而除去.
甲同学用如图1装置制备CaO并验证石膏与焦炭高温反应的其他产物.

实验过程中发现:B中无水硫酸铜变蓝,C中产生___现象证明有SO2生成,装置___中无明显变化和装置F中___现象证明有CO2生成.写出石膏与碳粉在高温条件下反应的化学方程式:___
二、硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如图2:

【资料二】氧化钙与焦炭在高温下反应生成碳化钙和一氧化碳.
(1)反应①的化学方程式为___.证明固体M中不含CaCO3的方法
是___(写出实验的方法、现象).
(2)反应②的化学方程式为(NH4)2SO4+2KCl═K2SO4↓+2NH4Cl,该反应能析出K2SO4晶体的原因是___.
(3)假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验.
【资料三】碳化钙在空气中灼烧生成氧化钙和二氧化碳气体.
步骤一:称取3.76g样品于图3所示石英管中(测定装置图如图3,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g.(玻璃纤维可防止固体粉末进入导管)

步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克.试回答下列问题:
①装置甲的作用是___.反应完全后继续缓缓通入空气的目的是___.
②根据步骤一、二计算该样品中钙、碳、氧的质量比为___,
计算确定CaCx的化学式(请写出计算过程)
③应用:丙同学经查阅资料知道实验室常用电石(主要成分为碳化钙)与水反应制取乙炔气体(发生装置如图4).经实验发现,电石与水反应非常剧烈,为控制反应的速度以得到平稳的气流,下列改进方法可行的是___
A.改长颈漏斗为分液漏斗或注射器 B.将电石研成粉末
C.将锥形瓶置于冰水浴中 D.用饱和食盐水代替水(电石与氯化钠不反应)