向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为40%NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,据图回答: (1)写出PM段发生的化学方程式.(2)P点溶液中的溶质是.(3)原混合物中CuCl2的质量是多少?(4)试通过计算确定m1的值.(5)M点溶液的溶质质量分数是多少?(结果保留0.1%)
2019-11-27
向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为40%NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,据图回答:
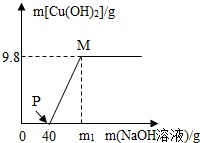
(1)写出PM段发生的化学方程式___.
(2)P点溶液中的溶质是___.
(3)原混合物中CuCl2的质量是多少?
(4)试通过计算确定m1的值.
(5)M点溶液的溶质质量分数是多少?(结果保留0.1%)
优质解答
(1)CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,
(2)P点表示氯化氢和氢氧化钠恰好完全反应,此时氯化铜还没和氢氧化钠反应,故溶液中的溶质为NaCl CuCl2;
(3)设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为x,生成氯化钠的质量为z,CuCl2的质量w
CuCl2+2NaOH═Cu(OH)2↓+2NaCl,
135 80 98 117
w x•40% 9.8g z
===
x=20g z=11.7g w=13.5g
(4)氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以m1=40g+20g=60g
(5)设氯化氢与氢氧化钠反应生成氯化钠的质量为y
NaOH+HCl═NaCl+H2O
40 58.5
40×40%=16g y
=
解得:y=23.4g
M点溶液中的溶质氯化钠的质量为11.7g+23.4gg=35.1g
M点溶液的溶质质量分数=×100%=23.4%
答:M点溶液的溶质质量分数为23.4%
故答案为:(1)CuCl2+2NaOH═Cu(OH)2↓+2NaCl;(2)NaCl CuCl2(3)13.5g(4)60g(5)23.4%.
(1)CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,
(2)P点表示氯化氢和氢氧化钠恰好完全反应,此时氯化铜还没和氢氧化钠反应,故溶液中的溶质为NaCl CuCl2;
(3)设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为x,生成氯化钠的质量为z,CuCl2的质量w
CuCl2+2NaOH═Cu(OH)2↓+2NaCl,
135 80 98 117
w x•40% 9.8g z
===
x=20g z=11.7g w=13.5g
(4)氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以m1=40g+20g=60g
(5)设氯化氢与氢氧化钠反应生成氯化钠的质量为y
NaOH+HCl═NaCl+H2O
40 58.5
40×40%=16g y
=
解得:y=23.4g
M点溶液中的溶质氯化钠的质量为11.7g+23.4gg=35.1g
M点溶液的溶质质量分数=×100%=23.4%
答:M点溶液的溶质质量分数为23.4%
故答案为:(1)CuCl2+2NaOH═Cu(OH)2↓+2NaCl;(2)NaCl CuCl2(3)13.5g(4)60g(5)23.4%.

