下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:(1)表中元素,化学性质最不活泼的是,只有负价而无正价的元素是.(2)C元素在元素周期表中的位置是第3周期第族.(3)最高价氧化物的水化物酸性最强的是,呈两性的是.(4)A分别与E、G、H形成的化合物中,最稳定的是.(5)在B、C、E、F中,原子半径最大的是.(6)B、H两种元素所形成的化合物所含的化学键类型为.(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式.(8)写出B与C两种元素的最高价氧化物对应的水化物相
2019-06-25
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
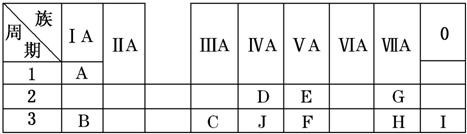
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的元素是___.
(2)C元素在元素周期表中的位置是第3周期第___族.
(3)最高价氧化物的水化物酸性最强的是___,呈两性的是___.
(4)A分别与E、G、H形成的化合物中,最稳定的是___.
(5)在B、C、E、F中,原子半径最大的是___.
(6)B、H两种元素所形成的化合物所含的化学键类型为___.
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式___.
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式___.

(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的元素是___.
(2)C元素在元素周期表中的位置是第3周期第___族.
(3)最高价氧化物的水化物酸性最强的是___,呈两性的是___.
(4)A分别与E、G、H形成的化合物中,最稳定的是___.
(5)在B、C、E、F中,原子半径最大的是___.
(6)B、H两种元素所形成的化合物所含的化学键类型为___.
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式___.
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式___.