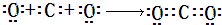现有NH3、F2、Cl2、Na、Fe、Na2O、Na2O2、SO2、CO2、NO2等中学化学常见物质,根据他们与水是否发生氧化还原反应进行分类.请回答下列问题:(1)图中所示的分类方法叫;(2)淡黄色固体位于组(填“A~E”),1mol该物质与水反应转移电子mol;该物质中所含化学键的类型为(填字母代号A离子键B极性键C非极性键).(3)用电子式表示A组中溶解度较小物质的形成过程:;(4)C组中某一物质须在加热时才能与水蒸气反应,其化学方程式为:3Fe+4H2O 高温 . F
2019-05-30
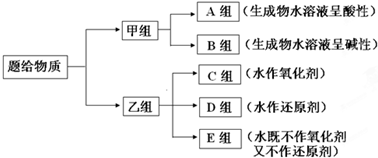
现有NH3、F2、Cl2、Na、Fe、Na2O、Na2O2、SO2、CO2、NO2等中学化学常见物质,根据他们与水是否发生氧化还原反应进行分类.
请回答下列问题:
(1)图中所示的分类方法叫______;
(2)淡黄色固体位于______组(填“A~E”),1mol该物质与水反应转移电子______mol;该物质中所含化学键的类型为______(填字母代号A离子键B极性键C非极性键).
(3)用电子式表示A组中溶解度较小物质的形成过程:______;
(4)C组中某一物质须在加热时才能与水蒸气反应,其化学方程式为:
(5)写出D组中任意一种物质与水反应的离子方程式:______.

请回答下列问题:
(1)图中所示的分类方法叫______;
(2)淡黄色固体位于______组(填“A~E”),1mol该物质与水反应转移电子______mol;该物质中所含化学键的类型为______(填字母代号A离子键B极性键C非极性键).
(3)用电子式表示A组中溶解度较小物质的形成过程:______;
(4)C组中某一物质须在加热时才能与水蒸气反应,其化学方程式为:
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
;
| ||
(5)写出D组中任意一种物质与水反应的离子方程式:______.