学习化学应该明确“从生活中来,到生活中去”的道理. (1)金币、铜币等金属货币在我国历史上曾发挥过重要的作用,若将金币、铜币分别放到稀硝酸中浸泡,能溶解的是,写出溶解时的离子方程(2)铝是一种较活泼的金属,在生产生活中有广泛的应用,铝与NaOH溶液反应的化学方程式为,因此铝制容器不能盛装NaOH溶液.(3)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量)①d过程中,可以观察到,说明饱和氯水中含有(填化学符号).②生产84消毒液对应的是(填“a”、“b”、“c”、“d”或“e”).
2019-11-28
学习化学应该明确“从生活中来,到生活中去”的道理.
(1)金币、铜币等金属货币在我国历史上曾发挥过重要的作用,若将金币、铜币分别放到稀硝酸中浸泡,能溶解的是___,写出溶解时的离子方程___
(2)铝是一种较活泼的金属,在生产生活中有广泛的应用,铝与NaOH溶液反应的化学方程式为___,因此铝制容器不能盛装NaOH溶液.
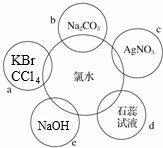
(3)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量)
①d过程中,可以观察到___,说明饱和氯水中含有___(填化学符号).
②生产84消毒液对应的是___(填“a”、“b”、“c”、“d”或“e”).发生的离子反应方程式为___
③a过程的现象为___.由此可得,氧化性___>___.
(4)硅石重要的半导体材料,工业上生产粗硅的反应方程式为___.

(1)金币、铜币等金属货币在我国历史上曾发挥过重要的作用,若将金币、铜币分别放到稀硝酸中浸泡,能溶解的是___,写出溶解时的离子方程___
(2)铝是一种较活泼的金属,在生产生活中有广泛的应用,铝与NaOH溶液反应的化学方程式为___,因此铝制容器不能盛装NaOH溶液.
(3)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量)
①d过程中,可以观察到___,说明饱和氯水中含有___(填化学符号).
②生产84消毒液对应的是___(填“a”、“b”、“c”、“d”或“e”).发生的离子反应方程式为___
③a过程的现象为___.由此可得,氧化性___>___.
(4)硅石重要的半导体材料,工业上生产粗硅的反应方程式为___.