优质解答
(1)过氧化钡中,钡离子与过氧根离子通过离子键结合,氧原子之间通过共价键结合,过氧化钡的电子式: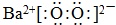 ;
;
故答案为: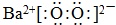 ;
;
(2)过氧化钡与二氧化碳和水反应生成碳酸钡和过氧化氢,化学方程式:BaO2+H2O+CO2=BaCO3+H2O2;
故答案为:BaO2+H2O+CO2=BaCO3+H2O2;
(3)BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水,离子方程式:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
故答案为:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
(4)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,要使得失电子守恒则高锰酸根离子系数为2,过氧化钡系数为5,依据原子个数守恒,反应的方程式:2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O;
故答案为:2;5;16H+;5;2;5O2↑;8. (1)过氧化钡中,钡离子与过氧根离子通过离子键结合,氧原子之间通过共价键结合,过氧化钡的电子式: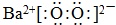 ;
;
故答案为: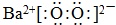 ;
;
(2)过氧化钡与二氧化碳和水反应生成碳酸钡和过氧化氢,化学方程式:BaO2+H2O+CO2=BaCO3+H2O2;
故答案为:BaO2+H2O+CO2=BaCO3+H2O2;
(3)BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水,离子方程式:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
故答案为:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
(4)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,要使得失电子守恒则高锰酸根离子系数为2,过氧化钡系数为5,依据原子个数守恒,反应的方程式:2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O;
故答案为:2;5;16H+;5;2;5O2↑;8.
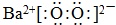 ;
;故答案为:
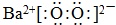 ;
;(2)过氧化钡与二氧化碳和水反应生成碳酸钡和过氧化氢,化学方程式:BaO2+H2O+CO2=BaCO3+H2O2;
故答案为:BaO2+H2O+CO2=BaCO3+H2O2;
(3)BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水,离子方程式:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
故答案为:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
(4)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,要使得失电子守恒则高锰酸根离子系数为2,过氧化钡系数为5,依据原子个数守恒,反应的方程式:2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O;
故答案为:2;5;16H+;5;2;5O2↑;8. (1)过氧化钡中,钡离子与过氧根离子通过离子键结合,氧原子之间通过共价键结合,过氧化钡的电子式:
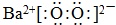 ;
;故答案为:
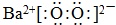 ;
;(2)过氧化钡与二氧化碳和水反应生成碳酸钡和过氧化氢,化学方程式:BaO2+H2O+CO2=BaCO3+H2O2;
故答案为:BaO2+H2O+CO2=BaCO3+H2O2;
(3)BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水,离子方程式:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
故答案为:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
(4)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,要使得失电子守恒则高锰酸根离子系数为2,过氧化钡系数为5,依据原子个数守恒,反应的方程式:2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O;
故答案为:2;5;16H+;5;2;5O2↑;8.