优质解答
由元素在周期表中的位置可知,①为H,②为N,③为O,④为F,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)⑥元素为Al,位于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)第三周期中阴离子大于阳离子半径,且具有相同排布的离子中原子序数大的离子半径小,则表中序号元素中半径最大的常见离子是S2-,故答案为:S2-;
(3)表中最高价氧化物对应水化物的碱性最强的物质为NaOH,其电子式为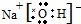 ;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,
;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,
故答案为: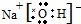 ;HClO4;HF;
;HClO4;HF;
(4)A.比较两种氢化物的熔沸点高低,水中含氢键沸点高,但一般不能利用熔沸点比较非金属性,角度不合理,故A选;
B.比较氢化物的稳定性,可知非金属性,故B不选;
C.通过和铁反应,比较得电子能力,则O得到电子能力强,可比较非金属性,故C不选;
D.通过置换反应,如氧气与硫化氢反应生成S,可比较非金属性,故D不选;
故答案为:A;
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,则化合物为N2H4,电子式为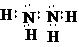 ,故答案为:
,故答案为: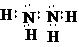 ;
;
(6)Si与Cl两元素的单质反应生成1molSi的最高价化合物SiCl4,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,
故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol. 由元素在周期表中的位置可知,①为H,②为N,③为O,④为F,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)⑥元素为Al,位于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)第三周期中阴离子大于阳离子半径,且具有相同排布的离子中原子序数大的离子半径小,则表中序号元素中半径最大的常见离子是S2-,故答案为:S2-;
(3)表中最高价氧化物对应水化物的碱性最强的物质为NaOH,其电子式为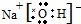 ;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,
;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,
故答案为: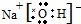 ;HClO4;HF;
;HClO4;HF;
(4)A.比较两种氢化物的熔沸点高低,水中含氢键沸点高,但一般不能利用熔沸点比较非金属性,角度不合理,故A选;
B.比较氢化物的稳定性,可知非金属性,故B不选;
C.通过和铁反应,比较得电子能力,则O得到电子能力强,可比较非金属性,故C不选;
D.通过置换反应,如氧气与硫化氢反应生成S,可比较非金属性,故D不选;
故答案为:A;
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,则化合物为N2H4,电子式为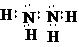 ,故答案为:
,故答案为: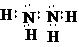 ;
;
(6)Si与Cl两元素的单质反应生成1molSi的最高价化合物SiCl4,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,
故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(1)⑥元素为Al,位于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)第三周期中阴离子大于阳离子半径,且具有相同排布的离子中原子序数大的离子半径小,则表中序号元素中半径最大的常见离子是S2-,故答案为:S2-;
(3)表中最高价氧化物对应水化物的碱性最强的物质为NaOH,其电子式为
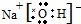 ;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,
;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,故答案为:
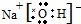 ;HClO4;HF;
;HClO4;HF;(4)A.比较两种氢化物的熔沸点高低,水中含氢键沸点高,但一般不能利用熔沸点比较非金属性,角度不合理,故A选;
B.比较氢化物的稳定性,可知非金属性,故B不选;
C.通过和铁反应,比较得电子能力,则O得到电子能力强,可比较非金属性,故C不选;
D.通过置换反应,如氧气与硫化氢反应生成S,可比较非金属性,故D不选;
故答案为:A;
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,则化合物为N2H4,电子式为
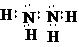 ,故答案为:
,故答案为: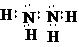 ;
;(6)Si与Cl两元素的单质反应生成1molSi的最高价化合物SiCl4,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,
故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol. 由元素在周期表中的位置可知,①为H,②为N,③为O,④为F,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)⑥元素为Al,位于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)第三周期中阴离子大于阳离子半径,且具有相同排布的离子中原子序数大的离子半径小,则表中序号元素中半径最大的常见离子是S2-,故答案为:S2-;
(3)表中最高价氧化物对应水化物的碱性最强的物质为NaOH,其电子式为
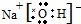 ;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,
;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,故答案为:
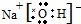 ;HClO4;HF;
;HClO4;HF;(4)A.比较两种氢化物的熔沸点高低,水中含氢键沸点高,但一般不能利用熔沸点比较非金属性,角度不合理,故A选;
B.比较氢化物的稳定性,可知非金属性,故B不选;
C.通过和铁反应,比较得电子能力,则O得到电子能力强,可比较非金属性,故C不选;
D.通过置换反应,如氧气与硫化氢反应生成S,可比较非金属性,故D不选;
故答案为:A;
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,则化合物为N2H4,电子式为
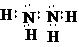 ,故答案为:
,故答案为: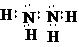 ;
;(6)Si与Cl两元素的单质反应生成1molSi的最高价化合物SiCl4,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,
故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.