某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )A. 电子流动方向为a→导线→bB. H+经质子交换膜由右向左移动C. 放电一段是时间b极附近pH不变D. a 电极发生反应为:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+
2019-03-31
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )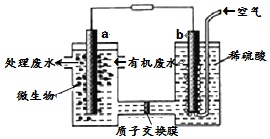
A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段是时间b极附近pH不变
D. a 电极发生反应为:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+