溶液的组成和配制是初中化学中的重要知识,在生产生活中有广泛的应用。 (1)右图为氯化钠、硝酸钾在水中的溶解度曲线。氯化钠溶液中的溶剂是 。20℃时,硝酸钾的溶解度约为 g。30℃时,硝酸钾的溶解度 氯化钠的溶解度。(填 “大于”、“小于”或“等于”)(2)某学校
2019-04-04
| 溶液的组成和配制是初中化学中的重要知识,在生产生活中有广泛的应用。 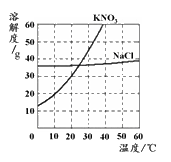 (1)右图为氯化钠、硝酸钾在水中的溶解度曲线。 氯化钠溶液中的溶剂是 。20℃时,硝酸钾的溶解度约为 g。30℃时,硝酸钾的溶解度 氯化钠的溶解度。(填 “大于”、“小于”或“等于”) (2)某学校化学兴趣小组用不纯的氯化钠固体(含有的杂质CaO)来配制一定溶质质量分数的NaCl溶液,实验的流程图如下: 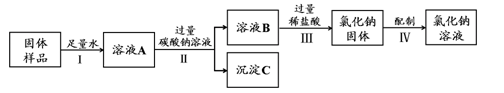 ①溶液A中的溶质为 。 ②操作II的名称是 。 ③过量稀盐酸加入到溶液B中所发生反应的化学方程式为 。 |