优质解答
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,说明其A具有变价,则A为Fe元素;B原子最外层电子数是内层电子总数的1/5,最外层电子数不超过8个,内层电子数为10的倍数,所以B有三个电子层,内层电子数是10,则B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C是N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素,
(1)A为Fe元素,在周期表中的位置为:第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)Mg与N元素形成的化合物的化学式为Mg3N2,它属于离子化合物,
故答案为:Mg3N2;离子;
(3)F为H、E为O,二者形成的18电子的化合物为H2O2,10电子的化合物为H2O,鉴别二者的方法为:分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象的是H2O,
故答案为:分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2;无明显现象的是H2O(其他合理方法同样给分);
(4)C与E都是较活泼的非金属元素,反应4NH3+3O2
2N2+6H2O中氧化剂是氧气、氧化产物是氮气,说明氧气的氧化性大于氮气,则非金属性:N
2N2+6H2O;
(5)A为Fe、B为Mg,证明二者单质还原性强弱方法可以为:取相同形状、相同大小的两种单质分别与相同浓度的稀盐酸反应,Mg的反应速率比Fe的反应速率快,证明还原性:Fe
(6)B为Mg、E为O元素,二者形成的化合物为MgO,氧化镁为离子化合物,用电子式不是其形成过程为: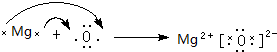 ,
,
故答案为: .
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,说明其A具有变价,则A为Fe元素;B原子最外层电子数是内层电子总数的1/5,最外层电子数不超过8个,内层电子数为10的倍数,所以B有三个电子层,内层电子数是10,则B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C是N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素,
.
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,说明其A具有变价,则A为Fe元素;B原子最外层电子数是内层电子总数的1/5,最外层电子数不超过8个,内层电子数为10的倍数,所以B有三个电子层,内层电子数是10,则B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C是N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素,
(1)A为Fe元素,在周期表中的位置为:第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)Mg与N元素形成的化合物的化学式为Mg3N2,它属于离子化合物,
故答案为:Mg3N2;离子;
(3)F为H、E为O,二者形成的18电子的化合物为H2O2,10电子的化合物为H2O,鉴别二者的方法为:分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象的是H2O,
故答案为:分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2;无明显现象的是H2O(其他合理方法同样给分);
(4)C与E都是较活泼的非金属元素,反应4NH3+3O2
2N2+6H2O中氧化剂是氧气、氧化产物是氮气,说明氧气的氧化性大于氮气,则非金属性:N
2N2+6H2O;
(5)A为Fe、B为Mg,证明二者单质还原性强弱方法可以为:取相同形状、相同大小的两种单质分别与相同浓度的稀盐酸反应,Mg的反应速率比Fe的反应速率快,证明还原性:Fe
(6)B为Mg、E为O元素,二者形成的化合物为MgO,氧化镁为离子化合物,用电子式不是其形成过程为: ,
,
故答案为: .
.
(1)A为Fe元素,在周期表中的位置为:第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)Mg与N元素形成的化合物的化学式为Mg3N2,它属于离子化合物,
故答案为:Mg3N2;离子;
(3)F为H、E为O,二者形成的18电子的化合物为H2O2,10电子的化合物为H2O,鉴别二者的方法为:分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象的是H2O,
故答案为:分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2;无明显现象的是H2O(其他合理方法同样给分);
(4)C与E都是较活泼的非金属元素,反应4NH3+3O2
| ||
| ||
(5)A为Fe、B为Mg,证明二者单质还原性强弱方法可以为:取相同形状、相同大小的两种单质分别与相同浓度的稀盐酸反应,Mg的反应速率比Fe的反应速率快,证明还原性:Fe
(6)B为Mg、E为O元素,二者形成的化合物为MgO,氧化镁为离子化合物,用电子式不是其形成过程为:
 ,
,故答案为:
 .
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,说明其A具有变价,则A为Fe元素;B原子最外层电子数是内层电子总数的1/5,最外层电子数不超过8个,内层电子数为10的倍数,所以B有三个电子层,内层电子数是10,则B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C是N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素,
.
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,说明其A具有变价,则A为Fe元素;B原子最外层电子数是内层电子总数的1/5,最外层电子数不超过8个,内层电子数为10的倍数,所以B有三个电子层,内层电子数是10,则B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C是N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素,(1)A为Fe元素,在周期表中的位置为:第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)Mg与N元素形成的化合物的化学式为Mg3N2,它属于离子化合物,
故答案为:Mg3N2;离子;
(3)F为H、E为O,二者形成的18电子的化合物为H2O2,10电子的化合物为H2O,鉴别二者的方法为:分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象的是H2O,
故答案为:分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2;无明显现象的是H2O(其他合理方法同样给分);
(4)C与E都是较活泼的非金属元素,反应4NH3+3O2
| ||
| ||
(5)A为Fe、B为Mg,证明二者单质还原性强弱方法可以为:取相同形状、相同大小的两种单质分别与相同浓度的稀盐酸反应,Mg的反应速率比Fe的反应速率快,证明还原性:Fe
(6)B为Mg、E为O元素,二者形成的化合物为MgO,氧化镁为离子化合物,用电子式不是其形成过程为:
 ,
,故答案为:
 .
.