以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是.(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液.实验室模拟氧化过程的实验装置如图所示.装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法.限用图D中的仪器(支撑仪器、导管、导线、石墨棒和
2020-01-09
以干海带为原料提取碘单质和氯化钾的过程主要分三步:
完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在___(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是___.
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液.实验室模拟氧化过程的实验装置如图所示.
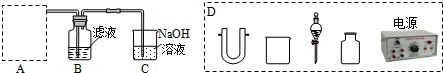
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法.限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是___(选填编号).
a.2NaCl(s)+MnO2+2H2SO4(浓)
MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O
2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是___.装置C中NaOH的作用是___.
(3)步骤三:取100mL B中富碘溶液,按如下流程分离碘单质.
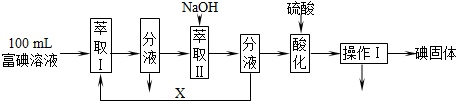
萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH-→5I-+IO3-+3H2O;
5I-+IO3-+6H+→3I2+3H2O;
萃取剂X应选择___(选填编号).
a.100mL苯b.10mL乙醇c.10mLCCl4d.10mL己烯
实验室进行萃取操作的仪器是___.操作Ⅰ的名称是___.
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:
①要用到的化学试剂是___(填写化学式);
②要测定的物理量是___.
完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在___(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是___.
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液.实验室模拟氧化过程的实验装置如图所示.

装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法.限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是___(选填编号).
a.2NaCl(s)+MnO2+2H2SO4(浓)
| △ |
| |
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O
| 通电 |
| |
d.4HCl(浓)+MnO2
| △ |
| |
广口瓶B中发生反应的离子方程式是___.装置C中NaOH的作用是___.
(3)步骤三:取100mL B中富碘溶液,按如下流程分离碘单质.

萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH-→5I-+IO3-+3H2O;
5I-+IO3-+6H+→3I2+3H2O;
萃取剂X应选择___(选填编号).
a.100mL苯b.10mL乙醇c.10mLCCl4d.10mL己烯
实验室进行萃取操作的仪器是___.操作Ⅰ的名称是___.
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:
①要用到的化学试剂是___(填写化学式);
②要测定的物理量是___.