将化学知识的系统化,有助于对化学问题的进一步认识.请你参与下列关于化学反应的讨论.问题1:从不同的角度,化学反应可以有不同的分类方法.四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的.请在图1的方框中,用集合的方法表示离子反应、化合反应和氧化还原反应之间的关系.问题2:化学反应中均伴随着能量的变化.如果一个化学反应中,反应物的总能量和生成物的总能量有如图2所示的关系,则该反应过程中的能量变化是.发射“神六”时用肼 (N2H4) 作为火
2019-05-30
将化学知识的系统化,有助于对化学问题的进一步认识.请你参与下列关于化学反应的讨论.
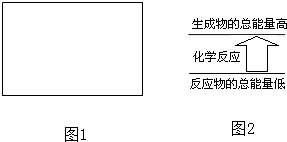
问题1:从不同的角度,化学反应可以有不同的分类方法.四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的.请在图1的方框中,用集合的方法表示离子反应、化合反应和氧化还原反应之间的关系.
问题2:化学反应中均伴随着能量的变化.如果一个化学反应中,反应物的总能量和生成物的总能量有如图2所示的关系,则该反应过程中的能量变化是______.发射“神六”时用肼 (N2H4) 作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知热化学方程式为:N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol (1)N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ/mol(2)请依据上述两反应完成N2H4与NO2发生燃烧反应的热化学方程式:______.
问题3:化学反应的发生是有条件的.反应物相同,反应的条件不同,反应的原理不同.如:4Na+O2=2Na2O 2Na+O2
Na2O2;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同:______.

问题1:从不同的角度,化学反应可以有不同的分类方法.四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的.请在图1的方框中,用集合的方法表示离子反应、化合反应和氧化还原反应之间的关系.
问题2:化学反应中均伴随着能量的变化.如果一个化学反应中,反应物的总能量和生成物的总能量有如图2所示的关系,则该反应过程中的能量变化是______.发射“神六”时用肼 (N2H4) 作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知热化学方程式为:N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol (1)N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ/mol(2)请依据上述两反应完成N2H4与NO2发生燃烧反应的热化学方程式:______.
问题3:化学反应的发生是有条件的.反应物相同,反应的条件不同,反应的原理不同.如:4Na+O2=2Na2O 2Na+O2
| ||
 ,
,