2019-04-20
微观与宏观相联系”是化学独特的思维方式,学习酸和碱的反应请结合图1示完成下列问题:
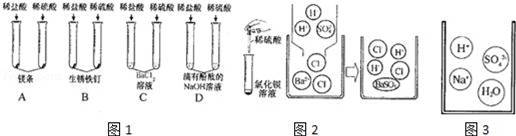

(1)初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH﹣=H2O.像这种实际参加反应的离子符号来表示反应的式子叫离子方程式,大部分的复分解反应都可用离子方程式来表示.
①不同酸具有相似的化学性质,但性质也存在差异.图2中能体现酸的通性的是 (填字母序号,下同);稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应生成白色沉淀,据图从微粒的角度分析写出该反应的实质是
②写出一个与离子方程式Mg+2H+=Mg2++H2↑相对应的化学方程式
③下列各组中的离子,能在溶液中大量共存的是
A.K+ H+ SO42﹣ OH﹣ B.Na+ Ca2+ CO32﹣ NO3﹣
C.Na+ H+ Cl﹣ CO32﹣ D.Na+ Cu2+ Cl﹣ SO42﹣
④酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或 成,反应就能发生.
(2)通过分析组成和结构,可以预测物质的某些性质.根据图3硫酸氢钠溶液的微观图示,分析推测NaHSO4,的性质,其中合理的是
A.其水溶液能与金属钾发生置换反应,得到金属钠 B.其水溶液能使紫色石蕊试液变红 C.其水溶液能与金属梓反应生成氢气 D.其水溶液能与硝酸钡溶液反应生成硫酸钡沉淀.