优质解答
根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、C、N、F、Na、Al、P、S、Cl、Ar元素,
(1)金属性最强的元素在元素周期表左下角、非金属性最强的元素在元素周期表的右上角,所以金属性最强的单质是Na,形成化合物种类最多的元素是C元素,元素的非金属性越强,最容易与H2反应,非金属性最强的元素是F,所以最容易与H2反应单质是F2,故答案为:Na;C;F2;
(2)⑧是S元素,S原子核外有3个电子层、最外层有6个电子,S原子结构示意图为: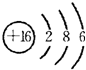 ,
,
故答案为: ;
;
(3)元素的非金属性越强,最高价氧化物所对应的水化物酸性最强(O、F除外),除了O、F元素外,Cl元素的非金属性最强,所以最高价氧化物所对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(4)非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,②与⑧形成的化合物是CS2,二硫化碳中C元素和S元素之间只存在共价键,所以属于共价化合物,故答案为:共价化合物;
(5)氧化铝属于两性氧化物,能和强酸强碱反应;高温下,铝和氧化铁发生铝热反应,反应方程式为:2Al+Fe2O3
2Fe+Al2O3,故答案为:氧化铝;2Al+Fe2O3
2Fe+Al2O3;
(6)元素的非金属性越强,其氢化物越稳定,N元素的非金属性大于P元素,所以③和⑦对应的氢化物较稳定的是NH3,故答案为:NH3;
(7)这些元素中,属于非金属元素的有:H、C、N、F、P、S、Cl、Ar,所以有8种,故答案为:8;
(8)⑨的单质是氯气,⑤的最高价氧化物对应的水化物反是NaOH,氯气能和强碱反应生成盐,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O. 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、C、N、F、Na、Al、P、S、Cl、Ar元素,
(1)金属性最强的元素在元素周期表左下角、非金属性最强的元素在元素周期表的右上角,所以金属性最强的单质是Na,形成化合物种类最多的元素是C元素,元素的非金属性越强,最容易与H2反应,非金属性最强的元素是F,所以最容易与H2反应单质是F2,故答案为:Na;C;F2;
(2)⑧是S元素,S原子核外有3个电子层、最外层有6个电子,S原子结构示意图为: ,
,
故答案为: ;
;
(3)元素的非金属性越强,最高价氧化物所对应的水化物酸性最强(O、F除外),除了O、F元素外,Cl元素的非金属性最强,所以最高价氧化物所对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(4)非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,②与⑧形成的化合物是CS2,二硫化碳中C元素和S元素之间只存在共价键,所以属于共价化合物,故答案为:共价化合物;
(5)氧化铝属于两性氧化物,能和强酸强碱反应;高温下,铝和氧化铁发生铝热反应,反应方程式为:2Al+Fe2O3
2Fe+Al2O3,故答案为:氧化铝;2Al+Fe2O3
2Fe+Al2O3;
(6)元素的非金属性越强,其氢化物越稳定,N元素的非金属性大于P元素,所以③和⑦对应的氢化物较稳定的是NH3,故答案为:NH3;
(7)这些元素中,属于非金属元素的有:H、C、N、F、P、S、Cl、Ar,所以有8种,故答案为:8;
(8)⑨的单质是氯气,⑤的最高价氧化物对应的水化物反是NaOH,氯气能和强碱反应生成盐,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
(1)金属性最强的元素在元素周期表左下角、非金属性最强的元素在元素周期表的右上角,所以金属性最强的单质是Na,形成化合物种类最多的元素是C元素,元素的非金属性越强,最容易与H2反应,非金属性最强的元素是F,所以最容易与H2反应单质是F2,故答案为:Na;C;F2;
(2)⑧是S元素,S原子核外有3个电子层、最外层有6个电子,S原子结构示意图为:
 ,
,故答案为:
 ;
;(3)元素的非金属性越强,最高价氧化物所对应的水化物酸性最强(O、F除外),除了O、F元素外,Cl元素的非金属性最强,所以最高价氧化物所对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(4)非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,②与⑧形成的化合物是CS2,二硫化碳中C元素和S元素之间只存在共价键,所以属于共价化合物,故答案为:共价化合物;
(5)氧化铝属于两性氧化物,能和强酸强碱反应;高温下,铝和氧化铁发生铝热反应,反应方程式为:2Al+Fe2O3
| ||
| ||
(6)元素的非金属性越强,其氢化物越稳定,N元素的非金属性大于P元素,所以③和⑦对应的氢化物较稳定的是NH3,故答案为:NH3;
(7)这些元素中,属于非金属元素的有:H、C、N、F、P、S、Cl、Ar,所以有8种,故答案为:8;
(8)⑨的单质是氯气,⑤的最高价氧化物对应的水化物反是NaOH,氯气能和强碱反应生成盐,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O. 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、C、N、F、Na、Al、P、S、Cl、Ar元素,
(1)金属性最强的元素在元素周期表左下角、非金属性最强的元素在元素周期表的右上角,所以金属性最强的单质是Na,形成化合物种类最多的元素是C元素,元素的非金属性越强,最容易与H2反应,非金属性最强的元素是F,所以最容易与H2反应单质是F2,故答案为:Na;C;F2;
(2)⑧是S元素,S原子核外有3个电子层、最外层有6个电子,S原子结构示意图为:
 ,
,故答案为:
 ;
;(3)元素的非金属性越强,最高价氧化物所对应的水化物酸性最强(O、F除外),除了O、F元素外,Cl元素的非金属性最强,所以最高价氧化物所对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(4)非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,②与⑧形成的化合物是CS2,二硫化碳中C元素和S元素之间只存在共价键,所以属于共价化合物,故答案为:共价化合物;
(5)氧化铝属于两性氧化物,能和强酸强碱反应;高温下,铝和氧化铁发生铝热反应,反应方程式为:2Al+Fe2O3
| ||
| ||
(6)元素的非金属性越强,其氢化物越稳定,N元素的非金属性大于P元素,所以③和⑦对应的氢化物较稳定的是NH3,故答案为:NH3;
(7)这些元素中,属于非金属元素的有:H、C、N、F、P、S、Cl、Ar,所以有8种,故答案为:8;
(8)⑨的单质是氯气,⑤的最高价氧化物对应的水化物反是NaOH,氯气能和强碱反应生成盐,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.