优质解答
(1)电解饱和食盐水的方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,反应中Cl元素的化合价升高2价,H元素的化合价降低2价,反应中转移2个电子,电子转移的方向和数目为: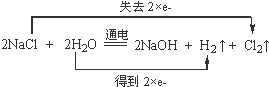 ,
,
故答案为: ;
;
(2)反应中Cl元素的化合价升高,则NaCl为还原剂,H元素的化合价降低,则H2O为氧化剂,故答案为:H2O;NaCl;
(3)电解饱和食盐水的方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,反应中Cl元素的化合价升高2价,H元素的化合价降低2价,反应中转移2个电子,则
每转移1mol电子,可得到0.5mol氯气;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;假设反应过程中无损耗,生成的氢气和氯气全部生成氯化氢,则依据元素守恒可知氯化钠中的氯元素全部转化为氯化氢中的氯元素,依据守恒计算得到:用电解所得气体制36.5%的浓盐酸100t,氯化氢质量为36.5t,NaCl~HCl,最少需要消耗食盐58.5t;
故答案为:0.5;58.5. (1)电解饱和食盐水的方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,反应中Cl元素的化合价升高2价,H元素的化合价降低2价,反应中转移2个电子,电子转移的方向和数目为: ,
,
故答案为: ;
;
(2)反应中Cl元素的化合价升高,则NaCl为还原剂,H元素的化合价降低,则H2O为氧化剂,故答案为:H2O;NaCl;
(3)电解饱和食盐水的方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,反应中Cl元素的化合价升高2价,H元素的化合价降低2价,反应中转移2个电子,则
每转移1mol电子,可得到0.5mol氯气;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;假设反应过程中无损耗,生成的氢气和氯气全部生成氯化氢,则依据元素守恒可知氯化钠中的氯元素全部转化为氯化氢中的氯元素,依据守恒计算得到:用电解所得气体制36.5%的浓盐酸100t,氯化氢质量为36.5t,NaCl~HCl,最少需要消耗食盐58.5t;
故答案为:0.5;58.5.
| ||
 ,
,故答案为:
 ;
;(2)反应中Cl元素的化合价升高,则NaCl为还原剂,H元素的化合价降低,则H2O为氧化剂,故答案为:H2O;NaCl;
(3)电解饱和食盐水的方程式为2NaCl+2H2O
| ||
每转移1mol电子,可得到0.5mol氯气;2NaCl+2H2O
| ||
故答案为:0.5;58.5. (1)电解饱和食盐水的方程式为2NaCl+2H2O
| ||
 ,
,故答案为:
 ;
;(2)反应中Cl元素的化合价升高,则NaCl为还原剂,H元素的化合价降低,则H2O为氧化剂,故答案为:H2O;NaCl;
(3)电解饱和食盐水的方程式为2NaCl+2H2O
| ||
每转移1mol电子,可得到0.5mol氯气;2NaCl+2H2O
| ||
故答案为:0.5;58.5.