氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3•6H2O),其工艺流程如下(杂质不参与反应):回答下列问题:(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是.(2)黄铁矿高温煅烧时发生反应的化学方程式.(3)酸溶及后续过程中均需保持盐酸过量,其目的是、.(4)系列操作包括:蒸发浓缩、、、洗涤等.蒸发与过滤时玻璃棒的作用分别是:、.(5)取a g黄铁矿,按上述流程制得FeCl3•
2019-04-20
氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3•6H2O),其工艺流程如下(杂质不参与反应):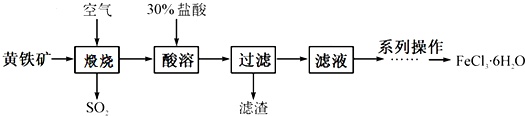
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是___.
(2)黄铁矿高温煅烧时发生反应的化学方程式___.
(3)酸溶及后续过程中均需保持盐酸过量,其目的是___、___.
(4)系列操作包括:蒸发浓缩、___、___、洗涤等.蒸发与过滤时玻璃棒的作用分别是:___、___.
(5)取a g黄铁矿,按上述流程制得FeCl3•6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为___ (用含a、b的表达式表示).

回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是___.
(2)黄铁矿高温煅烧时发生反应的化学方程式___.
(3)酸溶及后续过程中均需保持盐酸过量,其目的是___、___.
(4)系列操作包括:蒸发浓缩、___、___、洗涤等.蒸发与过滤时玻璃棒的作用分别是:___、___.
(5)取a g黄铁矿,按上述流程制得FeCl3•6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为___ (用含a、b的表达式表示).