尿素[CO(NH2)2]是首个由无机物人工合成的有机物.(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为2NH3+CO2 一定条件CO(NH2)2+H2O2NH3+CO2 一定条件CO(NH2)2+H2O.(2)当氨碳比n(NH3)n(CO2)=4,时CO2的转化率随时间的变化关系如图1所示.①A点的逆反应速率v逆(CO2)B点的正反应速率v正(CO2)(填“<”、“>”或“=”)②反应达到平衡后,NH3的转化率为.(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2.①电源
2019-04-19
尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为.
(2)当氨碳比=4,时CO2的转化率随时间的变化关系如图1所示.
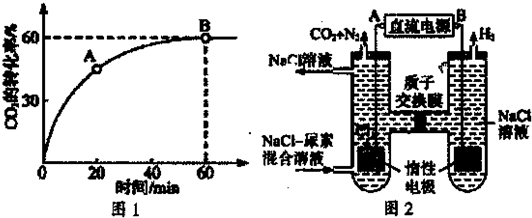
①A点的逆反应速率v逆(CO2)______B点的正反应速率v正(CO2)(填“<”、“>”或“=”)
②反应达到平衡后,NH3的转化率为______.
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2.
①电源的负极为______(填“A’或“B”).
②阳极室中发生的电极反应为______,请用化学方程式描述除去尿素的过程______.
③电解结束后,阴极室溶液的pH与电解前相比将______(填“变大”、“变小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为______g(忽略气体的溶解).
优质解答
(1)根据所学知识不难写出CO2和NH3合成CO(NH2)2的化学方程式为:2NH3+CO2 CO(NH2)2+H2O,
故答案为:2NH3+CO2 CO(NH2)2+H2O;
(2)①由CO2的转化率随时间变化图可知,在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,故答案为:小于;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,
2NH3+CO2 CO(NH2)2+H2O
起始/mol 4a a
转化/mol 1.2a 0.6a
平衡/mol 2.8a 0.4a
平衡时NH3转化率为:×100%=30%,
故答案为:30%;
(3)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律及本题图中的电极产物H2和Cl2,可以判断出A为电源的正极,B为电源的负极,故答案为:B;
②阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,
故答案为:2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)
阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与
OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的13.44 L气体中,V(N2)=V(CO2)==2.688L,
即n(N2)=n(CO2)=0.12 mol,根据方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]=0.12 mol×60 g•mol-1=7.2 g,
故答案为:不变;7.2.
(1)根据所学知识不难写出CO2和NH3合成CO(NH2)2的化学方程式为:2NH3+CO2 CO(NH2)2+H2O,
故答案为:2NH3+CO2 CO(NH2)2+H2O;
(2)①由CO2的转化率随时间变化图可知,在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,故答案为:小于;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,
2NH3+CO2 CO(NH2)2+H2O
起始/mol 4a a
转化/mol 1.2a 0.6a
平衡/mol 2.8a 0.4a
平衡时NH3转化率为:×100%=30%,
故答案为:30%;
(3)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律及本题图中的电极产物H2和Cl2,可以判断出A为电源的正极,B为电源的负极,故答案为:B;
②阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,
故答案为:2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)
阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与
OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的13.44 L气体中,V(N2)=V(CO2)==2.688L,
即n(N2)=n(CO2)=0.12 mol,根据方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]=0.12 mol×60 g•mol-1=7.2 g,
故答案为:不变;7.2.

