氮的固定意义重大,氮肥的大面积使用提高了粮食产量.(1)目前人工固氮有效且有意义的方法是(用一个化学方程式表示).(2)自然界发生的一个固氮反应是N2(g)+O2(g) 放电 . 2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收
2019-11-27
氮的固定意义重大,氮肥的大面积使用提高了粮食产量.
(1)目前人工固氮有效且有意义的方法是___(用一个化学方程式表示).
(2)自然界发生的一个固氮反应是N2(g)+O2(g)
2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ•mol-1、498kJ•mol-1、632kJ•mol-1,则该反应的△H=___kJ•mol-1.
(3)恒压100kPa时,反应2NO(g)+O2(g)⇌2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)⇌N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2.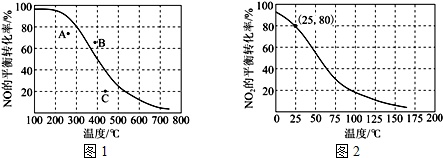
①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)⇌2NO2(g)达到平衡时NO的转化率,则___点对应的压强最大.
②恒压100kPa、25℃时,2NO2(g)⇌N2O4(g)平衡体系中N2O4的物质的量分数为___,列式计算平衡常数Kp=___.(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)室温下,用注射器吸入一定量NO2气体,将针头插入胶塞密封,然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间.从活塞固定时开始观察,气体颜色逐渐___(填“变深”或“变浅”),原因是___.[已知2NO2(g)⇌N2O4(g)在几微秒内即可达到化学平衡].
(1)目前人工固氮有效且有意义的方法是___(用一个化学方程式表示).
(2)自然界发生的一个固氮反应是N2(g)+O2(g)
| ||
(3)恒压100kPa时,反应2NO(g)+O2(g)⇌2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)⇌N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2.

①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)⇌2NO2(g)达到平衡时NO的转化率,则___点对应的压强最大.
②恒压100kPa、25℃时,2NO2(g)⇌N2O4(g)平衡体系中N2O4的物质的量分数为___,列式计算平衡常数Kp=___.(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)室温下,用注射器吸入一定量NO2气体,将针头插入胶塞密封,然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间.从活塞固定时开始观察,气体颜色逐渐___(填“变深”或“变浅”),原因是___.[已知2NO2(g)⇌N2O4(g)在几微秒内即可达到化学平衡].