“生物质“是指由植物或动物生命体衍生得到的物质的总称.“生物质能”是人类解决能源危机的一种重要的能源.“生物质”在一定条件下可气化为CO、H2等原料气,进而合成甲醇和二甲醚(CH3OCH3),相关反应为:①2H2(g)+CO(g)⇌CH3OH(g) ②4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)请根据图1所示回答问题:(1)由H2和CO合成二甲醚的热化学方程式是.(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成
2019-04-28
“生物质“是指由植物或动物生命体衍生得到的物质的总称.“生物质能”是人类解决能源危机的一种重要的能源.“生物质”在一定条件下可气化为CO、H2等原料气,进而合成甲醇和二甲醚(CH3OCH3),相关反应为:①2H2(g)+CO(g)⇌CH3OH(g) ②4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)
请根据图1所示回答问题: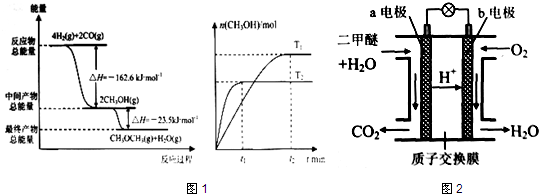
(1)由H2和CO合成二甲醚的热化学方程式是______.
(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1______K2 (选填“<”、“>”或“=”).
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),经一定时间反应②达到平衡状态,此时测得混合气体的密度是起始时的1.6倍.反应开始时正、逆反应速率的大小关系为V(正)______V(逆)(选填“>”、“<”或“=”),平衡时n(CH3OCH3)=______mol.
(4)如图2为绿色电源“二甲醚燃料电池”的工作原理示意图.(a、b均为多孔性Pt电极)b电极是______极.(填“正”或“负”)
a电极上的电极反应为______.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2mol•L-1Na2S04溶液等体积混合(忽略体积的变化>,则生成沉淀时,c的最小值是______.
请根据图1所示回答问题:

(1)由H2和CO合成二甲醚的热化学方程式是______.
(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1______K2 (选填“<”、“>”或“=”).
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),经一定时间反应②达到平衡状态,此时测得混合气体的密度是起始时的1.6倍.反应开始时正、逆反应速率的大小关系为V(正)______V(逆)(选填“>”、“<”或“=”),平衡时n(CH3OCH3)=______mol.
(4)如图2为绿色电源“二甲醚燃料电池”的工作原理示意图.(a、b均为多孔性Pt电极)b电极是______极.(填“正”或“负”)
a电极上的电极反应为______.
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol•L-1CaCl2溶液与2.00×10-2mol•L-1Na2S04溶液等体积混合(忽略体积的变化>,则生成沉淀时,c的最小值是______.