以下是某市实验操作考查的内容,请回答相关问题.[实验目的]证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质;[实验原理](用化学方程式表示);[药品仪器][实验步骤]①取(填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;②用(填仪器名称)向①中溶液滴加稀盐酸,直至红色消失;③向②中溶液继续滴加过量稀盐酸,溶液保持无色;④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生.[实验反思](1)实验中滴加2滴酚酞的作用是;(2)步骤③的目的是;(3)如不使用酸碱指示剂,进一步确认步骤④中的白色固
2019-06-21
以下是某市实验操作考查的内容,请回答相关问题.
[实验目的]
证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质;
[实验原理]
(用化学方程式表示)______;
[药品仪器]
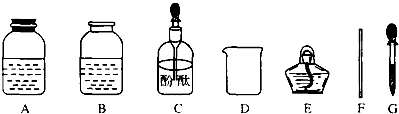
[实验步骤]
①取______(填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用______(填仪器名称)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色;
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生.
[实验反思]
(1)实验中滴加2滴酚酞的作用是______;
(2)步骤③的目的是_______;
(3)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是______.
(4)小张同学取用了20g氢氧化钠溶液进行实验,消耗3.65%的稀盐酸20g时,恰好完全反应.请计算氢氧化钠溶液的溶质质量分数为多少?反应后溶液中溶质质量分数为多少?
(5)已知常温下,氯化钠的溶解度为36g,现将反应后的氯化钠溶液变为饱和溶液,可加入溶质多少克?若采用蒸发溶剂的方法,需要蒸发多少克水可转化为饱和溶液?(只列式,不计算)
(6)将20g配置好的上述浓度的氢氧化钠溶液敞口放置一段时间后,向其中滴加3.65%的稀盐酸,待恰好完全反应后,消耗的稀盐酸______20g.(填“大于”“小于”或“等于”)
[实验目的]
证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质;
[实验原理]
(用化学方程式表示)______;
[药品仪器]

[实验步骤]
①取______(填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用______(填仪器名称)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色;
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生.
[实验反思]
(1)实验中滴加2滴酚酞的作用是______;
(2)步骤③的目的是_______;
(3)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是______.
(4)小张同学取用了20g氢氧化钠溶液进行实验,消耗3.65%的稀盐酸20g时,恰好完全反应.请计算氢氧化钠溶液的溶质质量分数为多少?反应后溶液中溶质质量分数为多少?
(5)已知常温下,氯化钠的溶解度为36g,现将反应后的氯化钠溶液变为饱和溶液,可加入溶质多少克?若采用蒸发溶剂的方法,需要蒸发多少克水可转化为饱和溶液?(只列式,不计算)
(6)将20g配置好的上述浓度的氢氧化钠溶液敞口放置一段时间后,向其中滴加3.65%的稀盐酸,待恰好完全反应后,消耗的稀盐酸______20g.(填“大于”“小于”或“等于”)