(10分)化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。(1) 从物质的分类角度看,不恰当的一种物质是。(填写化学式)(2) "三酸”的稀溶液均能作为NH 3 的吸收剂广三酸”中的任意“一酸”与KH 3 反应的离子方程式是(3) 纯碱生产工艺是沿用化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下: ①沉淀池中发生的化学反应方程式是②使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环 (填“ I ”或“II”)。(4) 若将1mol/L盐酸逐滴加入
2019-11-27
| (10分)化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。 (1) 从物质的分类角度看,不恰当的一种物质是________。(填写化学式) (2) "三酸”的稀溶液均能作为NH 3 的吸收剂广三酸”中的任意“一酸”与KH 3 反应的离子方程式是________________________________ (3) 纯碱生产工艺是沿用化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下: 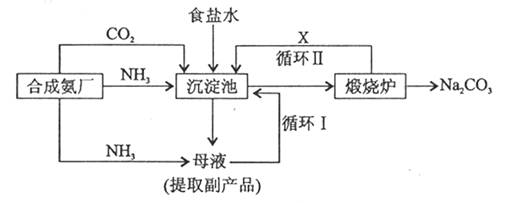 ①沉淀池中发生的化学反应方程式是________________ ②使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环________ (填“ I ”或“II”)。 (4) 若将1mol/L盐酸逐滴加入0.5mol/L烧碱溶液至恰好完全中和,所得溶液中的离子浓度大小顺序是________________________ |
