元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:(1)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的相同,处于同一列的N和P位于元素周期表的第族.(2)通过元素周期表,我们可以知道:①氮元素的最低化合价为,其气态氢化物的结构式为.②原子半径:r(P)r(S)(填“>”、“<”或“=”).③在上表所列元素的最高价氧化物对应水化物中酸性最强的是(写化学式),写出硝酸的电离方程式.④Cl的非金属性(填“强于”、“弱于”或“等于”)Br的非金属性,海水提溴的原
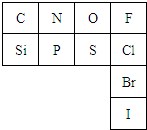 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
(1)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的______相同,处于同一列的N和P位于元素周期表的第______族.
(2)通过元素周期表,我们可以知道:
①氮元素的最低化合价为______,其气态氢化物的结构式为______.
②原子半径:r(P)______r(S)(填“>”、“<”或“=”).
③在上表所列元素的最高价氧化物对应水化物中酸性最强的是______(写化学式),写出硝酸的电离方程式______.
④Cl的非金属性______(填“强于”、“弱于”或“等于”)Br的非金属性,海水提溴的原理是用氯气将溴离子氧化,请写出氯气与溴化钠溶液反应的化学方程式,并标出电子转移的方向和数目.______.
2019-06-25
 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:(1)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的______相同,处于同一列的N和P位于元素周期表的第______族.
(2)通过元素周期表,我们可以知道:
①氮元素的最低化合价为______,其气态氢化物的结构式为______.
②原子半径:r(P)______r(S)(填“>”、“<”或“=”).
③在上表所列元素的最高价氧化物对应水化物中酸性最强的是______(写化学式),写出硝酸的电离方程式______.
④Cl的非金属性______(填“强于”、“弱于”或“等于”)Br的非金属性,海水提溴的原理是用氯气将溴离子氧化,请写出氯气与溴化钠溶液反应的化学方程式,并标出电子转移的方向和数目.______.
 ,故答案为:-3;
,故答案为:-3;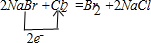 ,
,