HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题: (1)假如氨制NO的产率是96%,NO制硝酸的产率是92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为m3(四舍五入保留整数部分).(2)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失).①设循环操作的次数为n,NO2→HNO3转化率与循
2019-04-03
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:
(1)假如氨制NO的产率是96%,NO制硝酸的产率是92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为___m3(四舍五入保留整数部分).
(2)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失).
①设循环操作的次数为n,NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式为___.
②一定量的二氧化氮气体要经过___次循环操作,才能使95%的二氧化氮转变为硝酸.
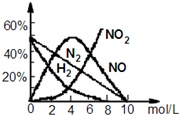
(3)上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3.实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物.例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O.生成这些产物的HNO3浓度范围为:c(H2)<6.6mol/L、c(N2)<10mol/L、c(NH4+)<10mol/L、0.1mol/L<c(NO)<10mol/L、c(NO2)>0.1mol/L.各气相产物成分及含量随HNO3浓度变化曲线如图所示.
①写出Mg与11mol/L的HNO3反应的化学方程式___.
②960 g Mg与1000L 4mol/L的HNO3恰好完全反应,常温常压下收集到244 L气体,试通过计算写出反应方程式___.

(1)假如氨制NO的产率是96%,NO制硝酸的产率是92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为___m3(四舍五入保留整数部分).
(2)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失).
①设循环操作的次数为n,NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式为___.
②一定量的二氧化氮气体要经过___次循环操作,才能使95%的二氧化氮转变为硝酸.
(3)上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3.实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物.例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O.生成这些产物的HNO3浓度范围为:c(H2)<6.6mol/L、c(N2)<10mol/L、c(NH4+)<10mol/L、0.1mol/L<c(NO)<10mol/L、c(NO2)>0.1mol/L.各气相产物成分及含量随HNO3浓度变化曲线如图所示.
①写出Mg与11mol/L的HNO3反应的化学方程式___.
②960 g Mg与1000L 4mol/L的HNO3恰好完全反应,常温常压下收集到244 L气体,试通过计算写出反应方程式___.