工业中很多的物质制备及其除杂蕴藏很多的化学原理,请根据要求回答下列问题:I.海水提溴是重要的化工操作,其对应的操作流程如下:(1)步骤I的操作步骤有 ,将得到的固体制成稀溶液进行电解可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式: (2)Ⅱ中调节溶液pH为3.5能更有效地提高C12的利用率,其理由是 (3)Ⅲ中Br2转化为NaBr,NaBr03的离子方程式为 .
2020-02-07
工业中很多的物质制备及其除杂蕴藏很多的化学原理,请根据要求回答下列问题:I.海水提溴是重要的化工操作,其对应的操作流程如下:
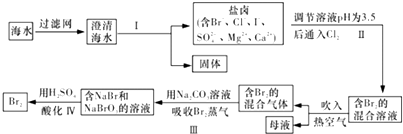
(1)步骤I的操作步骤有 ___,将得到的固体制成稀溶液进行电解可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式: ___
(2)Ⅱ中调节溶液pH为3.5能更有效地提高C12的利用率,其理由是 ___
(3)Ⅲ中Br2转化为NaBr,NaBr03的离子方程式为 ___.
优质解答
澄清海水经过滤后得到固体和盐卤溶液,溶液调节pH为3.5后通入氯气可生成溴,在含有溴的混合溶液中吹入空气,可得到含有溴的混合气体,加入碳酸钠溶液吸收溴,得到含有NaBr和NaBrO的溶液,然后用硫酸酸化,NaBr和NaBrO发生还原反应生成溴,
(1)澄清海水经步骤I后得到固体和盐卤溶液,则步骤I涉及蒸发、结晶、过滤,电解氯化钠稀溶液可制备“84消毒液”,则在阳极生成NaClO,阴极生成氢气,电解方程式为NaCl+H2ONaClO+H2↑,故答案为:蒸发、结晶、过滤;NaCl+H2ONaClO+H2↑;
(2)氯气和水反应生成盐酸和次氯酸,调节溶液pH约为3.5,可抑制氯气与水的反应,使氯气充分与溴化钠反应,
故答案为:抑制氯气与水的反应,提高氯气的利用率;
(3)Br2与碳酸钠溶液反应生成NaBr,NaBr03,反应的离子方程式为3Br2+3CO32-=5Br-+BrO3-+3CO2↑,故答案为:3Br2+3CO32-=5Br-+BrO3-+3CO2↑.
澄清海水经过滤后得到固体和盐卤溶液,溶液调节pH为3.5后通入氯气可生成溴,在含有溴的混合溶液中吹入空气,可得到含有溴的混合气体,加入碳酸钠溶液吸收溴,得到含有NaBr和NaBrO的溶液,然后用硫酸酸化,NaBr和NaBrO发生还原反应生成溴,
(1)澄清海水经步骤I后得到固体和盐卤溶液,则步骤I涉及蒸发、结晶、过滤,电解氯化钠稀溶液可制备“84消毒液”,则在阳极生成NaClO,阴极生成氢气,电解方程式为NaCl+H2ONaClO+H2↑,故答案为:蒸发、结晶、过滤;NaCl+H2ONaClO+H2↑;
(2)氯气和水反应生成盐酸和次氯酸,调节溶液pH约为3.5,可抑制氯气与水的反应,使氯气充分与溴化钠反应,
故答案为:抑制氯气与水的反应,提高氯气的利用率;
(3)Br2与碳酸钠溶液反应生成NaBr,NaBr03,反应的离子方程式为3Br2+3CO32-=5Br-+BrO3-+3CO2↑,故答案为:3Br2+3CO32-=5Br-+BrO3-+3CO2↑.

