CO2 和CH4 是两种主要的温室气体,以CH4 和CO2 为原料太阳能制造更高价值的化学产品是目前缓解温室效应的研究方向.回答下列问题:(1)由CO2 制取C的太阳能 工艺如图1所示.①“热分解系统”发生的反应为2Fe3O4 >2300K .
2019-04-20
CO2 和CH4 是两种主要的温室气体,以CH4 和CO2 为原料太阳能制造更高价值的化学产品是目前缓解温室效应的研究方向.回答下列问题:
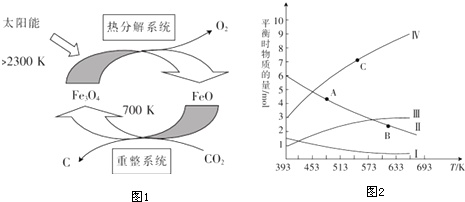
(1)由CO2 制取C的太阳能 工艺如图1所示.
①“热分解系统”发生的反应为2Fe3O4
6FeO+O2↑,则每分解1mol Fe3O4转移电子的物质的量为
___②“重整系统”发生反应的化学方程式为___
(2)一定条件下,CO2和CH4反应可生产合成气(CO、的混合气体),其可用于合成多种液体燃料.
已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41.0kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=___kJ•mol-1
(3)CO2催化加氢可合成低碳烯烃.起始时在0.1MPa下,以n(H2):n(CO2)=3:1的投料比将反应物充入反应器中,发生反应:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)△H,保持压强不变,不同温度下平衡时的四种气态物质的物质的量如图2所示.
①曲线Ⅱ表示的物质为___(填化学式),该反应的△H___(填“>”或“<”)0.
②A、B两点对应的反应速率v(A)、v(B)的大小关系为___.B、C两点对应温度下反应的平衡常数大小关系为K(B)___(填“>”“<”或“=”)K(C).
③为提高CO2 的平衡转化率,除改变温度外,还可采取的措施是举1种).

(1)由CO2 制取C的太阳能 工艺如图1所示.
①“热分解系统”发生的反应为2Fe3O4
| ||
___②“重整系统”发生反应的化学方程式为___
(2)一定条件下,CO2和CH4反应可生产合成气(CO、的混合气体),其可用于合成多种液体燃料.
已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41.0kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=___kJ•mol-1
(3)CO2催化加氢可合成低碳烯烃.起始时在0.1MPa下,以n(H2):n(CO2)=3:1的投料比将反应物充入反应器中,发生反应:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)△H,保持压强不变,不同温度下平衡时的四种气态物质的物质的量如图2所示.
①曲线Ⅱ表示的物质为___(填化学式),该反应的△H___(填“>”或“<”)0.
②A、B两点对应的反应速率v(A)、v(B)的大小关系为___.B、C两点对应温度下反应的平衡常数大小关系为K(B)___(填“>”“<”或“=”)K(C).
③为提高CO2 的平衡转化率,除改变温度外,还可采取的措施是举1种).