作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一.重庆一中某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究.I 甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到重庆后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知如图1信息:①醋分两种,酿造醋和配制醋.正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋.②酿造醋国家标准为醋酸含量必须大
2019-04-19
作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一.重庆一中某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究.
I 甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到重庆后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知如图1信息: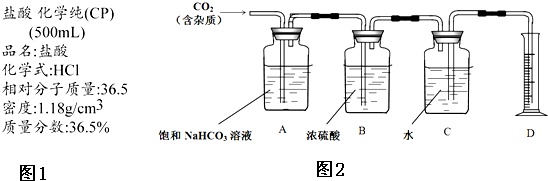
①醋分两种,酿造醋和配制醋.正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋.
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~3.50g/100mL.
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L.
(1)请帮助张同学计算从超市购买的食醋中醋酸含量为___g/100mL,属于___醋(填“酿造”或“配制”).(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式___.
II 如图2是重庆一中化学实验室浓盐酸试剂标签上的部分内容.乙同学现用该浓盐酸配制100mL 1mol•L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有___;
(2)经计算,配制100mL1mol•L-1的稀盐酸需要用量筒量取上述浓盐酸的体积为___mL(保留小数点后一位);
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol•L-1,引起误差的原因可能是___.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
III 丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣.
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为___.
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为___.
IV 丁同学试图测定CO2的相对分子质量.
①利用丙同学用完后剩下的鸡蛋壳和乙同学配制好的稀盐酸溶液制备CO2;
②查询相关书籍后,设计了如下装置:
(1)B装置在此处___必要(填写“有”、“无”)请简述原因___.
(2)A装置中的饱和NaHCO3溶液可以吸收___.
(3)实验前测得C装置(含水)重量为50.00g,实验完毕后C装置(含水)重量为40.02g,D中量筒读数为10.0mL,已知H2密度为0.09g/L(以上数据均已折合为标况下数值),请根据以上数据,计算CO2的相对分子质量为___(保留小数点后一位).
I 甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到重庆后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知如图1信息:

①醋分两种,酿造醋和配制醋.正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋.
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~3.50g/100mL.
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L.
(1)请帮助张同学计算从超市购买的食醋中醋酸含量为___g/100mL,属于___醋(填“酿造”或“配制”).(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式___.
II 如图2是重庆一中化学实验室浓盐酸试剂标签上的部分内容.乙同学现用该浓盐酸配制100mL 1mol•L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有___;
(2)经计算,配制100mL1mol•L-1的稀盐酸需要用量筒量取上述浓盐酸的体积为___mL(保留小数点后一位);
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol•L-1,引起误差的原因可能是___.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
III 丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣.
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为___.
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为___.
IV 丁同学试图测定CO2的相对分子质量.
①利用丙同学用完后剩下的鸡蛋壳和乙同学配制好的稀盐酸溶液制备CO2;
②查询相关书籍后,设计了如下装置:
(1)B装置在此处___必要(填写“有”、“无”)请简述原因___.
(2)A装置中的饱和NaHCO3溶液可以吸收___.
(3)实验前测得C装置(含水)重量为50.00g,实验完毕后C装置(含水)重量为40.02g,D中量筒读数为10.0mL,已知H2密度为0.09g/L(以上数据均已折合为标况下数值),请根据以上数据,计算CO2的相对分子质量为___(保留小数点后一位).