A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,相关物质间的关系如图1所示.(1)H的化学式是.(2)反应①的化学方程式是.(3)反应②的离子方程式是.(4)电解法制D的低价氢氧化物的装置如图2.a是4mol•L-1 NaCl、1mol•L-1 NaOH的混合溶液.①配制a时需要除去蒸馏水中溶解的O2,常采用的方法.②石墨电极应与电源的(填“正”或“负”)极相连接,通电后,R极附近的现象是,R极的电极反应式是.③实验停止一段时间后,在R极上部有红褐色物质产
2019-04-20
A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,相关物质间的关系如图1所示.
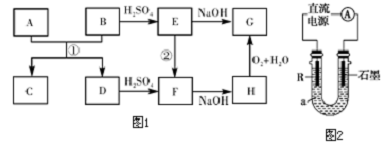
(1)H的化学式是___.
(2)反应①的化学方程式是___.
(3)反应②的离子方程式是___.
(4)电解法制D的低价氢氧化物的装置如图2.a是4mol•L-1 NaCl、1mol•L-1 NaOH的混合溶液.
①配制a时需要除去蒸馏水中溶解的O2,常采用___的方法.
②石墨电极应与电源的___(填“正”或“负”)极相连接,通电后,R极附近的现象是___,R极的电极反应式是___.
③实验停止一段时间后,在R极上部有红褐色物质产生,发生反应的化学方程式是___.
优质解答
A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,则反应①为铝热反应,所以A为Al,D为Fe,C为Al2O3,B为铁的氧化物,D与硫酸反应生成F为FeSO4,F与氢氧化钠反应生成H为Fe(OH)2,H氧化得G为Fe(OH)3,所以E为Fe2(SO4)3,则B为Fe2O3,
(1)根据上面的分析可知,H的化学式是Fe(OH)2,故答案为:Fe(OH)2;
(2)反应①的化学方程式是 Fe2O3+2AlAl2O3+2Fe,故答案为:Fe2O3+2AlAl2O3+2Fe;
(3)反应②为硫酸铁与铁反应生成硫酸亚铁,反应的离子方程式是Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(4)①配制4mol•L-1 NaCl、1mol•L-1 NaOH的混合溶液时需要除去蒸馏水中溶解的O2,常采用煮沸的方法,故答案为:煮沸;
②电解法制Fe(OH)2时,用铁做阳极,石墨做阴极,所以石墨电极应与电源的负极相连接,通电后,在电解池的阳极附近有氢氧化亚铁产生,出现的现象是有白色沉淀生成,阳极的电极反应式是 Fe+2OH--2e-═Fe(OH)2,
故答案为:负;有白色沉淀生成;Fe+2OH--2e-=Fe(OH)2;
③实验停止一段时间后,在R极上部氢氧化亚铁被空气中的氧气氧化,有红褐色物质产生,发生反应的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,则反应①为铝热反应,所以A为Al,D为Fe,C为Al2O3,B为铁的氧化物,D与硫酸反应生成F为FeSO4,F与氢氧化钠反应生成H为Fe(OH)2,H氧化得G为Fe(OH)3,所以E为Fe2(SO4)3,则B为Fe2O3,
(1)根据上面的分析可知,H的化学式是Fe(OH)2,故答案为:Fe(OH)2;
(2)反应①的化学方程式是 Fe2O3+2AlAl2O3+2Fe,故答案为:Fe2O3+2AlAl2O3+2Fe;
(3)反应②为硫酸铁与铁反应生成硫酸亚铁,反应的离子方程式是Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(4)①配制4mol•L-1 NaCl、1mol•L-1 NaOH的混合溶液时需要除去蒸馏水中溶解的O2,常采用煮沸的方法,故答案为:煮沸;
②电解法制Fe(OH)2时,用铁做阳极,石墨做阴极,所以石墨电极应与电源的负极相连接,通电后,在电解池的阳极附近有氢氧化亚铁产生,出现的现象是有白色沉淀生成,阳极的电极反应式是 Fe+2OH--2e-═Fe(OH)2,
故答案为:负;有白色沉淀生成;Fe+2OH--2e-=Fe(OH)2;
③实验停止一段时间后,在R极上部氢氧化亚铁被空气中的氧气氧化,有红褐色物质产生,发生反应的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.

