下列为元素周期表中的一部分,用化学式或元素符号回答下列问题: 族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0二⑥⑦三①③⑤⑧⑩四②④⑨(1)11种元素中,化学性质最不活泼的是.(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是.(3)②③④中形成的简单离子半径由大到小的顺序是.(4)元素⑦的氢化物分子式为,该氢化物常温下和元素②的单质反应的离子方程式是,该氢化物与元素⑧的单质反应的离子方程式是.(
2019-06-25
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是______.
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是______.
(3)②③④中形成的简单离子半径由大到小的顺序是______.
(4)元素⑦的氢化物分子式为______,该氢化物常温下和元素②的单质反应的离子方程式是______,该氢化物与元素⑧的单质反应的离子方程式是______.
(5)①和⑨的最高价氧化物对应的水化物的化学式为______和______.①和⑨两元素形成化合物的化学式为______,该化合物灼烧时焰色为______色,该化合物的水溶液与元素⑧的单质反应的离子方程式为______.
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为______.
(7)⑧⑨ 三种元素形成的气态氢化物最稳定的是______.
三种元素形成的气态氢化物最稳定的是______.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | 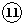 | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是______.
(3)②③④中形成的简单离子半径由大到小的顺序是______.
(4)元素⑦的氢化物分子式为______,该氢化物常温下和元素②的单质反应的离子方程式是______,该氢化物与元素⑧的单质反应的离子方程式是______.
(5)①和⑨的最高价氧化物对应的水化物的化学式为______和______.①和⑨两元素形成化合物的化学式为______,该化合物灼烧时焰色为______色,该化合物的水溶液与元素⑧的单质反应的离子方程式为______.
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为______.
(7)⑧⑨
 三种元素形成的气态氢化物最稳定的是______.
三种元素形成的气态氢化物最稳定的是______.