锆(40Zr)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛.以锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆及其化合物的流程如图所示:(1)ZrSiO4中锆元素的价态是;上述流程中,高温气化存在多个反应,若不考虑反应中的损失,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,原因是.SiCl4的电子式为.(2)高温气化后的固体残渣除C外,还有Al2O3和FeCl3,加水浸取得氯化铁溶液,过滤,从滤渣中分离出C和
2019-04-22
锆(40Zr)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛.以锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆及其化合物的流程如图所示:
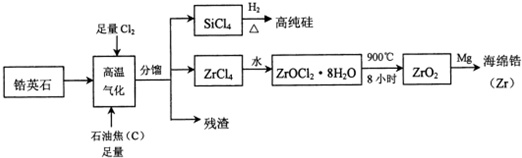
(1)ZrSiO4中锆元素的价态是___;上述流程中,高温气化存在多个反应,若不考虑反应中的损失,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,原因是___.SiCl4的电子式为___.
(2)高温气化后的固体残渣除C外,还有Al2O3和FeCl3,加水浸取得氯化铁溶液,过滤,从滤渣中分离出C和A12O3两种固体的方法是___.
(3)写出上述流程中ZrCl4与水反应的化学方程式:___.
(4)锆还是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是___(填序号).
a.锆合金比纯锆的熔点高,硬度小
b.二氧化锆陶瓷属于新型无机非金属材料
c.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
d.可采用氦作反应堆包裹核燃料的锆合金的冷却剂
(5)工业上电解K2ZrF6与KCl等组成的熔体也可制取金属锆.电解的总反应方程式为___.
(6)某燃料电池是以C2H4作为燃料气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-,则负极上发生的反应式为___.
优质解答
锆英石(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),通入足量的氯气以及和足量的石焦油反应,ZrSiO4转化为ZrCl4,加水水解,使ZrCl4转化为ZrOCl2•8H2O,900℃加热分解,即可得到ZrO2,加入镁置换得到海绵锆,加入镁置换得到海绵锆.
(1)根据在化合物中正负化合价代数和为零,氧元素显-2价,硅元素显+4价,设锆元素(Zr)的化合价是x,可知ZrSiO4中锆元素(Zr)的化合价:x+(+4)+(-2)×4=0,则x=+4,锆英石(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),杂质SiO2也能在高温气化条件下反应生成SiCl4,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,SiCl4分子中硅原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氯原子能形成一个共价键达到稳定结构,电子式为: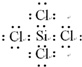 ,
,
故答案为:+4;因为杂质中的SiO2也通过反应产生了SiCl4;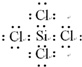 ;
;
(2)氧化铝为两性氧化物,易溶于强酸强碱,碳不溶于非氧化性酸,不溶于碱,从滤渣中分离出C和A12O3两种固体:加碱浸取过滤得到C,再向滤液中通入足量CO2,过滤后将固体加热得到氧化铝.(或加酸浸取过滤得到C,再向滤液中加氨水,过滤后将固体加热得到氧化铝),
故答案为:加碱浸取过滤得到C,再向滤液中通入足量CO2,过滤后将固体加热得到氧化铝.(或加酸浸取过滤得到C,再向滤液中加氨水,过滤后将固体加热得到氧化铝);
(3)ZrCl4与水反应产物为ZrOCl2•8H2O,根据原子守恒,反应方程式为:ZrCl4+9H2O═ZrOCl2•8H2O+2HCl,
故答案为:ZrCl4+9H2O═ZrOCl2•8H2O+2HCl;
(4)a.合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点 低于组成它的成分金属的熔点,所以锆合金比纯锆的熔点低,硬度大,故a错误;
b.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故b正确;
c.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故c错误;
d.氦为稀有气体,可采用氦作反应堆包裹核燃料的锆合金的冷却剂,故d正确;
故答案为:bd;
(5)电解K2ZrF6与KCl等组成的熔体,反应物为K2ZrF6、KCl,生成物为金属锆,锆的化合价降低(+4→0),则氯的化合价升高生成氯气(-1→0),转移4e-,根据原子守恒即得失电子守恒所以方程式为:K2ZrF6+4KClZr+6KF+2Cl2↑,
故答案为:K2ZrF6+4KClZr+6KF+2Cl2↑;
(6)该燃料电池中通入乙烯的一极为负极,发生氧化反应,乙烯失电子和氧离子反应生成二氧化碳和水,电极反应式为:C2H4+6O2--12e-═2CO2+2H2O,
故答案为:C2H4+6O2--12e-═2CO2+2H2O.
锆英石(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),通入足量的氯气以及和足量的石焦油反应,ZrSiO4转化为ZrCl4,加水水解,使ZrCl4转化为ZrOCl2•8H2O,900℃加热分解,即可得到ZrO2,加入镁置换得到海绵锆,加入镁置换得到海绵锆.
(1)根据在化合物中正负化合价代数和为零,氧元素显-2价,硅元素显+4价,设锆元素(Zr)的化合价是x,可知ZrSiO4中锆元素(Zr)的化合价:x+(+4)+(-2)×4=0,则x=+4,锆英石(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),杂质SiO2也能在高温气化条件下反应生成SiCl4,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,SiCl4分子中硅原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氯原子能形成一个共价键达到稳定结构,电子式为: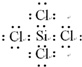 ,
,
故答案为:+4;因为杂质中的SiO2也通过反应产生了SiCl4;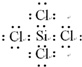 ;
;
(2)氧化铝为两性氧化物,易溶于强酸强碱,碳不溶于非氧化性酸,不溶于碱,从滤渣中分离出C和A12O3两种固体:加碱浸取过滤得到C,再向滤液中通入足量CO2,过滤后将固体加热得到氧化铝.(或加酸浸取过滤得到C,再向滤液中加氨水,过滤后将固体加热得到氧化铝),
故答案为:加碱浸取过滤得到C,再向滤液中通入足量CO2,过滤后将固体加热得到氧化铝.(或加酸浸取过滤得到C,再向滤液中加氨水,过滤后将固体加热得到氧化铝);
(3)ZrCl4与水反应产物为ZrOCl2•8H2O,根据原子守恒,反应方程式为:ZrCl4+9H2O═ZrOCl2•8H2O+2HCl,
故答案为:ZrCl4+9H2O═ZrOCl2•8H2O+2HCl;
(4)a.合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点 低于组成它的成分金属的熔点,所以锆合金比纯锆的熔点低,硬度大,故a错误;
b.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故b正确;
c.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故c错误;
d.氦为稀有气体,可采用氦作反应堆包裹核燃料的锆合金的冷却剂,故d正确;
故答案为:bd;
(5)电解K2ZrF6与KCl等组成的熔体,反应物为K2ZrF6、KCl,生成物为金属锆,锆的化合价降低(+4→0),则氯的化合价升高生成氯气(-1→0),转移4e-,根据原子守恒即得失电子守恒所以方程式为:K2ZrF6+4KClZr+6KF+2Cl2↑,
故答案为:K2ZrF6+4KClZr+6KF+2Cl2↑;
(6)该燃料电池中通入乙烯的一极为负极,发生氧化反应,乙烯失电子和氧离子反应生成二氧化碳和水,电极反应式为:C2H4+6O2--12e-═2CO2+2H2O,
故答案为:C2H4+6O2--12e-═2CO2+2H2O.


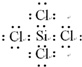 ,
,