氮、磷、砷为同主族元素,回答下列问题:(1)基态As原子的核外电子排布式为.(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是 (用元素符号表示)(3)As4O6的分子结构如图1所示,其中As原子的杂化方式为,1mol As406含有σ键的物质的量为.(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是.A.稳定性
2020-02-07
氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为___.
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是___ (用元素符号表示)
(3)As4O6的分子结构如图1所示,其中As原子的杂化方式为___,1mol As406含有σ键的物质的量为___.
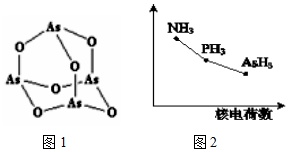
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是___.
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是___
(6)NH4+中的H-N-H的键角比 NH3中的H-N-H的键角___(填”大”或”小”),原因是___
___.
(1)基态As原子的核外电子排布式为___.
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是___ (用元素符号表示)
(3)As4O6的分子结构如图1所示,其中As原子的杂化方式为___,1mol As406含有σ键的物质的量为___.

(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是___.
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是___
(6)NH4+中的H-N-H的键角比 NH3中的H-N-H的键角___(填”大”或”小”),原因是___
___.