回归、改进、拓展教材实验,是高考化学实验考查的常见形式.Ⅰ.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第Ⅷ族的Fe、Co、Ni可能有相似的催化机理.【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性. (1)写出H2O2溶液在Fe3+催化下分解的化学方程式.(
2019-04-20
回归、改进、拓展教材实验,是高考化学实验考查的常见形式.
Ⅰ.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第Ⅷ族的Fe、Co、Ni可能有相似的催化机理.
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性.
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式___.
(2)①该催化剂中铁元素的化合价为___.
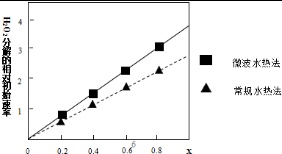
②如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:___法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是___.
Ⅱ.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“Ⅲ”等为Mn的价态):
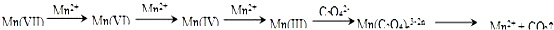
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
【设计、完成实验】
(3)称取___g草酸晶体(H2C2O4•2H2O),配制500mL 0.10mol/L H2C2O4溶液.在上述过程中必须用到的2种定量仪器是托盘天平和___
(4)完成探究,记录数据
仔细阅读分析表中数据,回答问题:
x=___mL,假设___成立(填“1”、“2”或“3”)
Ⅰ.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第Ⅷ族的Fe、Co、Ni可能有相似的催化机理.
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性.

(1)写出H2O2溶液在Fe3+催化下分解的化学方程式___.
(2)①该催化剂中铁元素的化合价为___.
②如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:___法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是___.
Ⅱ.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“Ⅲ”等为Mn的价态):
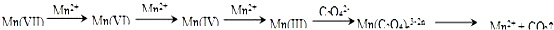
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
【设计、完成实验】
(3)称取___g草酸晶体(H2C2O4•2H2O),配制500mL 0.10mol/L H2C2O4溶液.在上述过程中必须用到的2种定量仪器是托盘天平和___
(4)完成探究,记录数据
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
x=___mL,假设___成立(填“1”、“2”或“3”)