2019-04-20
甲醇是一种可再生能源,具有广泛的开发和应用前景。
( l )已知在常温常压下反应的热化学方程式:
① CO ( g ) + 2H 2 ( g ) = CH 3 OH ( g ) △ H 1 = -90 kJ · mol -1
② CO ( g ) + H 2 O ( g ) = CO 2 ( g ) + H 2 ( g ) △ H 2 = -41 kJ · mol -1
写出由二氧化碳、氢气制备甲醇的热化学方程式:
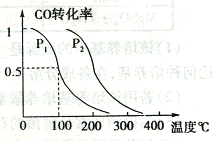 ( 2 )在压强为 0.1MPa 条件下.容积为 V L 的容器中充入 a mol CO 与 2 a mo1H 2 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示;
( 2 )在压强为 0.1MPa 条件下.容积为 V L 的容器中充入 a mol CO 与 2 a mo1H 2 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示;
① P 1 P 2 (填大于、小于或等于) ;
② 在其它条件不变的情况下,再增加 a mol CO 与 2 a mo1H 2 ,达到新平衡时, CO 的转化率 (填 “ 增大 ” 、 “ 减小 ” 或 “ 不变 ” ,下同),平衡常数 。
( 3 )以甲醇为燃料的新型燃料电池,正极通入 O 2 ,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是: CH 3 OH + H 2 O-6e - = CO 2 + 6H +
① 正极的电极反应式是 ;放电时, H + 移向电池的 (填 “ 正 ” 或 “ 负 ” )极;
② 若以该燃料电池作为电源,用石墨作电极电解 500mL 饱和食盐水,当两极共收集到标准状况下的气体 1.12 L (以不考虑气体的溶解)时,所得溶液的 pH = (假设反应前后溶液体积不变)。