氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H键断裂,则形成的π键有mol,N2H4的沸点比C2H6的主要原因是.(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为.(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图.写出该反应的化学方程式:.(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(
2020-02-08
氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H键断裂,则形成的π键有___mol,N2H4的沸点比C2H6的主要原因是___.
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为___.
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图.写出该反应的化学方程式:___.
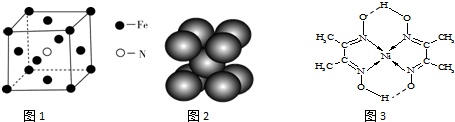
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是
___(填序号).
a.常温下,N2很稳定,是因为N的电离能大
b.钠晶胞结构见图2,每个晶胞含有5个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有___(填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有___.
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H键断裂,则形成的π键有___mol,N2H4的沸点比C2H6的主要原因是___.
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为___.
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图.写出该反应的化学方程式:___.

(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是
___(填序号).
a.常温下,N2很稳定,是因为N的电离能大
b.钠晶胞结构见图2,每个晶胞含有5个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有___(填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有___.