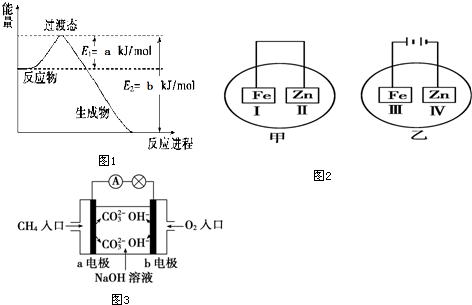
(1)如图1是工业氮气和氢气合成1mol氨气过程中能量变化示意图,请写出该反应的热化学方程式:.(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.已知:C(s,石墨)+O2(g)═C02(g)△H1=-393.5kJ•mol-12H2(g)+O2(g)=H2O(l)△H2=-571.6kJ•mol-12C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H
2019-06-21
(1)如图1是工业氮气和氢气合成1mol氨气过程中能量变化示意图,请写出该反应的热化学方程式:___.
(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═C02(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=___.
(3)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图2所示.
正极上发生的电极反应为___
阴极上发生的电极反应为___
(4)如图3是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是___(填“a”或“b”)极,负极的电极反应式是:___.
②电池工作一段时间后电解质溶液的pH___(填“增大”、“减小”或“不变”)

(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═C02(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=___.
(3)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图2所示.
正极上发生的电极反应为___
阴极上发生的电极反应为___
(4)如图3是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是___(填“a”或“b”)极,负极的电极反应式是:___.
②电池工作一段时间后电解质溶液的pH___(填“增大”、“减小”或“不变”)